Внутривидовая структура кеты
В настоящее время имеются многочисленные сведения о внутривидовойнеоднородности кеты. На Дальнем Востоке первоначально выделены две расы вида: летняя и осенняя, различающиеся срокамианадромной миграции, биологическими характеристиками и экологическими адаптациями, присущими им в период воспроизводства (Берг, 1948, 1953). Главное различие рас заключается в особенностях размножения: осенняя кета нерестится на выходах грунтовых вод, инкубация икрылетней кеты происходит в подрусловом потоке (Смирнов А.Г., 1947; Леванидов, 1968, 1976). Кроме того, выделяются различные группировки и локальные стада как осенней, так и летней кеты, отличающиеся сроками и местами нереста, биологическими характеристиками. Довольно подробный обзор внутривидовых группировок кеты по азиатскому участку ареала приведен в монографиях А.И. Смирнова (1975) и А.Н. Макоедова с соавторами (2009).
Летняя раса описана в качестве основной, типичной формы вида (Берг, 1948). Она широко расселилась, область ее распространения охватываетбореальную и арктическую зоны. Распространение типично осенней расы кеты связано в основном с системой Палеоамура: Амур, реки Приморья, Сахалина, острова Курильского и Японского архипелагов. Формы кеты, сходные с летней и осенней расами, имеются в бассейне Юкона и реках, входивших в систему Палеококона в плиоцен-плейстоцене. Так, в Юконе, например, размножаются две группировки кеты: «silver» — хорошо упитанные, менее зрелые серебристые рыбы, поднимающиеся по реке для нереста на расстояние до 2800 км (Bucklis, Barton, 1984), и «dog salmon» — менее упитанные рыбы, имеющие уже в устьевой зоне хорошо выраженный брачный наряд и размножающиеся в нижнем течении реки. Эти разновидности кеты различаются сроками нерестовой миграции (Gilbert, 1924).
На основании сроков нерестовой миграции и морфологического сходства кеты северных популяций некоторые авторы считают, что северовосточную часть Азии и арктическое побережье материка населяет только летняя кета (Правдин, 1940; Берг, 1948; Андрияшев, 1954; Иванков, 1970, Куликова, 1972; Черешнев, 1980, 1981). Однако имеются данные, свидетельствующие об экологической и внутривидовой неоднородности кеты, обитающей на Камчатке, материковом побережье Охотского моря и в бас. р. Анадырь.
Так, на Камчатке летняя по срокам нерестового хода (июль-август) кета предпочитает для размножения ключевые протоки, заливы, затоны и лимнокрены с выходами грунтовых вод, что характерно для осенней расы вида (Кузнецов И.И., 1928, 1937; Крохин, Крогиус, 1937; Смирнов, 1975). Однако, кроме указанной, на Камчатке есть и типично летняя формакеты, мигрирующая на нерест намного раньше (с первых чисел июня) и преобладающая в северозападных районах полуострова. В юго-западной части Камчатки соотношение летней и осенней (по срокам нереста) кеты примерно равное или доминирует осенняя форма (Бирман, 1964). Представляет интерес описанная В.В. Абрамовым (1948) форма
поздненерестующей (до декабря) кеты — манока, размножение которой в отличие от кеты позднего хода происходит вместах, не имеющих выходов грунтовых вод. Однако эта форма требует более основательного изучения. В последние годы экология кеты Камчатки исследована довольно подробно. Установлено, что в реках Камчатки сосуществуют четыре внутривидовые сезонные формы (расы) — весенняя, летняя ранняя, летняя поздняя и осенняя, нерестовый ход которых продолжается с мая по октябрь (Николаева, Овчинников, 1988; Макоедов, Овчинников, 1992; Заварина, 1994; Овчинников, Макоедов, 1994, Николаева и др., 1995, Кузищин и др., 2010).
В бас. р. Анадырь по экологии размножения отмечены формы вида, сходные с летней и осенней кетой (Остроумов, 1967; Штундюк, 1982, Путивкин, |989). Летняя и осенняя расы кеты имеются на Сахалине (Гриценко и др., 1987). В бас. Амура и сахалинской р. Поронай отмечена форма осенней кеты, размножающаяся на нерестилищах, водоснабжение которых осуществляется за счет вод подруслового потока (Махинов, Золотухин, 1999, Золотухин, 2009). Согласно устному сообщению С.Ф. Золотухина, нерест кеты этой формы происходит в конце сентября — начале октября при температуре воды 6—8°С в ряде притоков р. Амур второго порядка.
На материковом побережье Охотского моря некоторые авторы также предполагали возможность существования летней и осенней форм кеты, размножающихся как на русловых, таки на ключевых нерестилищах (Правдин, 1940, Костарев, 1970в). Воспроизводящиеся в указанном районе формы кеты иногда трудно различимы по срокаманадромной миграции, которые могут перекрываться. Однако изучение репродуктивнойэкологии показываетгетерогенность популяций кеты, Имеющиеся в нашем распоряжении материалы позволяют более детально рассмотреть особенности внутривидовых группировок кеты этого региона и попытаться проанализировать пути и закономерности их формирования.
В реках материкового побережья Охотского моря воспроизводятся две формы кеты — ранняя и поздняя, различающиеся по особенностям экологии (Волобуев, 1983a, 1984, 1986). Ранняя кета воспроизводится как в крупных реках (Ола, Кава, Кухтуй, Охота), протяженностью до 200—400 км, так и в малых (Иткилан, Мотыклейка, Быструха и др.), длиной 30—50 км. В настоящее время в крупных реках материкового побережья Охотского моря преобладает, как правило, поздняя, в малых — ранняя формакеты,
Наиболее полно исследована экология кеты в бас. р. Тауй — крупнейшей реке Тауйской губы. Ранняя кета мигрирует на нерест в июне-июле, поздняя — с конца июля по ноябрь, Кета раннего хода размножается в бас, р. Кава, притоке тундрового типа, поздняя — вр. Челомджа, являющейся притоком горного типа. Нерестранней кеты происходит в июле — начале августа в русловой части реки притоках первого и второго порядка. Размножение происходит при температуре воды 9,8—13,6°С, скорости течения 0,2—0,8 м/с; pH воды колеблется от 6,7 до 7,1, содержание кислорода — от 9,0 до 10,7 мг/л. Вместах нереста ранней кеты не обнаружено выходов грунтовых вод, икраинкубируется в подрусловом потоке. В декабре температура воды на нерестилищах снижается до 0,1°С. Такие же показатели температурного режима воды (9,8—13,6, в среднем 11,9°С) приведены И.И. Кузнецовым (1937) для устьевых районов нерестовых рек, где размножается летняя кета Амура. Непосредственно на нерестилищах в период размножения летней амурской кеты температура составляла 6-7°C,
В русле рек ранняя охотоморская кета строит нерестовые бугры на участках с галечным грунтом в конце плесов перед перекатами, где скорость руслового и подруслового потоков наибольшая, а также на глубине до 1,5—2,0 м. Топография нерестилищ ранней кеты сходна сместами размножения горбуши. Зачастую нерестовые бугры ранней кеты и горбуши располагаются вперемешку. Большая глубина, на которой размещаются гнезда кеты, препятствует промерзанию нерестилищ в основном русле рек в зимнее время, а повышенный гидростатический напор наложе реки перед перекатом вместах локализации нерестовых гнезд обеспечивает их удовлетворительную проточностъ,
В малых реках и притоках первого и второго порядка нерестовые площадки ранней кеты расположены на плесах глубиной 0,3—0,5 м. Казалось бы, в отсутствие притока теплых грунтовых води низких температурах воздухамелководные нерестилища должны зимой промерзать, однако в ряде случаев этого не происходит. Например, промерзанию нерестовых бугров в водотоках, расположенных в тундровой местности, обычно препятствует слой снега, который доверху заносит профиль ложа ручьев, выполняя роль теплоизолятора. Такую ситуацию мы наблюдали на нерестилищах ранней кеты вруч. Бюки Кременец — притоках второго порядка р. Кава.
Размножение поздней кеты приурочено к нерестилищам ключевого типа, расположенным, как правило, на выходах грунтовых вод. Скорость течения в местах нереста составляет 0,1—0,8 м/c, pH 6,3—6,4, глубина — от 0,2 до 1,5—2,0 м. Участки речных систем, на которых происходит размножение поздней кеты, отличаются довольно устойчивым дебитом грунтового потока в течение года и меньшими, чем в русле рек, годовыми колебаниями температуры. В летнее время температура воды на нерестилищах ниже, чем в основном русле рек. В течение зимнего периода эти участки характеризуются повышенными температурами воды по отношению к русловому потоку. На контрольных нерестилищах в бас. pp. Челомджа и Яма за счет интенсивного притока теплых ключевых вод температура воды к апрелю не опускается ниже 1,1—2,4°C. На нерестилищах с меньшим дебитом ключевых вод температура воды в течение зимы падает до 0,5-0,8°C.
В связи с этим вместах нереста поздней кеты в зимнее время образуются полыньи — незамерзающие участки рек с довольно устойчивым температурным режимом, приуроченные к выходам грунтовых вод, которые и определяют своеобразие гидрологического режима нерестилищ поздней кеты. Эта особенность гидрологии лососевых рек используется для картирования нерестилищ поздней формы кеты и оценки их площади (Рогатных, Морозов, 1988). В своем происхождении грунтовые воды связаны, во-первых, с приповерхностными (таликовыми) рыхлыми гравийными и песчано-галечными отложениями в поймах рек, в которых залетний период аккумулируются запасы воды за счет инфильтрации поверхностного стока и атмосферных осадков. Во-вторых, на температурный режим грунтовых водоказывают влияние теплые подмерзлотные воды, наличие которых обусловлено напорной восходящей фильтрацией подземных вод глубинного залегания по трещинами разломам земной коры (Романовский, 1983). Залегание подмерзлотных вод в бассейнах рек Магаданской области отмечено на глубине от 40 до 200 м и более (Калабин, 1960). Температура воды на выходах ключей на контрольных нерестилищах р. Челомджа в конце октября составляет 5,5—8,2°С. Термический режим подрусловых и пойменных таликов в случае отсутствия примеси глубинных вод незначительно отличается от температуры руслового потока, которая в зимнее время близка к 0°C.
По особенностям размножения поздняя охотоморская кета, по сути, является аналогом или викарирующей экологической формой амурской осенней кеты. По данным одного из первых исследователей осенней амурской кеты И.И. Кузнецова (1937), ее массовое размножение происходит в октябре при температуреводы 6°С, продолжаясь до ноября-декабря при температуре воды на ключах 2—4°С. Такие же формы кеты, воспроизводящиеся на подрусловом потоке и на ключах, отмечены на Сахалине (Гриценко и др., 1987) и в бас.р. Анадырь (Штундюк, 1983, 1987; Путивкин, 1999;Макоедов и др., 2000).
Помимо особенностей гидрологического режима нерестилищ, кета обеих форм различается и по биологическим характеристикам. Ранняя кета мельче поздней. Так, например, средняя длина ранней кеты в 1981 и 1983 г. составляла 59,7 и 60,1 см, масса—2,62 и 3,13 кг, поздней — соответственно 61,9 и 65,0 см и 3,65 и 4,43 кг. Однако нерестующие самки ранней кеты характеризуются большей плодовитостью по сравнению с одноразмерными особями позднего хода, Это обусловлено меньшими размерами икринок, что характерно для летней расы вида (Бирман, 1952). У обеих форм кеты модальная возрастная группа представлена 4-летними рыбами (3+). Кета ранней и поздней форм достоверно различается по количествужаберных лучей (t = 4,39, p > 0,999) и пилорических придатков (, - 2,80, p - 0,99).
Ранняя и поздняя формы кеты различаются темпами эмбрионально-личиночного развития. У ранней кеты высокая скорость развития наблюдается в начальный период эмбриогенеза, что обусловлено повышенной температурой воды в летние месяцы. В дальнейшем, с понижением температуры, развитие эмбрионов тормозится.
Для поздней кеты характерен более равномерный темп развития, что также связано с особенностями температурного режима нерестилищ этой формы. Диапазонизменений температурного режима в период инкубации икры поздней кеты уже, что является результатом инкубации икрыв более благоприятных условиях среды.
Проведенные совместно с кафедрой ихтиологии МГУ работы по изучению генетической структуры кеты показали, что ранняя и поздняя формы различаются по генетическим характеристикам. Они были исследованы методом молекулярной гибридизации ДНК. Установлено, что в популяции кеты р. Тауй выделяются два нетрансгрессирующих уровня дивергенции, соответствующие двум формам. В качестве основного критерия внутривидовой гетерогенностикеты использован показатель АТ.". Значение ДТ для кеты р. Кава (ранняя форма) равно 78,18°, для кеты р. Челомджа (поздняя форма) — 79,48°, что свидетельствует о несоответствии в структуре ДНК кеты сравниваемых форм (Медников и др., 1988). Известно, что различие по показателю AT в 1,3°C соответствует 1—2% неправильно спаренных нуклеотидных последовательностей вмолекулах ДНК (McCarthy, Farquhar, 1972). Кета ранней и поздней форм достоверно различается значениями АТ, по критерию Стьюдента(t = 3,52, p > 0,99),
Наличие в стадахкеты ранней и поздней форм, размножающихся на разных типах нерестилищ, накладывает отпечаток и надинамику численности вида. Доля нерестилищ ключевого типа в реках материкового побережья Охотского моря довольно стабильна, узколокализована и во много раз меньше нерестовой площади рек, потенциально пригодной для размножения ранней формы кеты.
Как уже отмечалось, кета, обитающая в реках материкового побережья Охотского моря, по срокам нерестовой миграции (июнь—август) сходна слетней формой, однако по особенностям репродуктивной экологии у нее выделяются два экотипа: экотип ранней кеты-аналоглетней расы и экотип поздней кеты — аналог осенней расы. Летние сроки нерестовой миграции охотоморской кеты, размножающейся на выходах грунтовых вод, не являются свидетельством происхождения этой кеты от летней расы. Они выработались, закрепились отбором и обеспечивают нормальное протекание процесса размножения кеты в регионе с суровыми климатическими условиями и коротким периодом вегетации, По эффективности и стабильности воспроизводства, устойчивости к воздействию факторов среды кета летней и кета осенней форм неадекватны. Летняя кета, как и горбуша, размножающаяся в русловой части рек, в значительной степени подвержена негативному влиянию абиотических условий. Это является одним из основных факторов, определяющих ее численность. Резкое сокращение запасов ранней кеты в Охотском районе после нескольких неблагоприятных для воспроизводства лет (Костарев, 1964б, 1970б) свидетельствует о том, что ее численность может значительно флуктуировать. Воспроизводство поздней кеты протекает в более стабильных условиях. Выходы относительно теплых грунтовых вод обеспечивают благоприятные условия развития икры и препятствуют промерзанию нерестовых гнезд. Численность поздней кеты колеблется в меньшей степени и в значительной мере определяется емкостью нерестового фонда, нежели условиями среды в период размножения.
На нерестилищах поздней кеты в годы мощных подходов мы видели, что часть производителей вытесняется за пределы участков с выходами грунтовых вод. При этом роль подруслового потока в водоснабжении нерестовых гнезд поздней кеты возрастает. По-видимому, для кеты характерно использование нетипичных нерестовых участков в условиях высокой численности. В связи с этим можно полагать, что начальные этапы внутривидовой дифференциации связаны с периодами повышенной численности вида.
"Показатель AT — температура, при которой в процессе денатурации «распадается» 50% спирали ДНК.
Вопросы о месте и точной датировке возникновения кеты до сих пор остаются дискуссионными. Мы их не рассматриваем из-за явного отсутствия убедительных фактов и исходим из того, что в начале четвертичного периода предковая форма этого вида уже заселила ряд водоемов Северо-Востока Азии. Затем в силу неоднородности условий существования и действия факторов эволюции в популяциях кеты происходила внутривидовая дивергенция. По нашему мнению, формообразование дальневосточной кеты можно представить в виде следующей схемы. В условиях высокой численности размножение кеты осуществлялось на участках с различным соотношением грунтовых и подрусловых вод. Дифференциация, вероятно, происходила через этапы расхождения по типам нерестилищ и выработки соответствующего комплекса адаптаций для успешного воспроизводства при разных темпах эмбриогенеза: более равномерном на ключевых и «скачкообразном» на русловых нерестилищах. В популяциях кеты в результате симпатрической дивергенции происходило обособление экофенотипов, тяготеющих к воспроизводству на нерестилищах того или иного типа. Вероятно, получили предпочтение адаптации, направленные намаксимальное использование нерестовых площадей. Дальнейшее накопление и закрепление различий в результате дизруптивного отбора, очевидно, привело к экологической и генетической неоднородности популяций.
Процесс симпатрического формообразования происходил, скорее всего, одновременно и независимо во многих водоемах, и в реках материкового побережья Охотского моря в том числе, но скорость формообразования, естественно, была неодинакова. Не исключено также, что, возникнув первоначальнов пределах одного речного бассейна, например, в Амуре, ранняя и поздняя формы могли расселиться в другие водоемы. Как показывает практика расселения горбуши из бассейна Баренцева моря на восток, для этого не требуется длительного исторического отрезка времени, особенно если учесть, что у ранней кеты, которая размножается на подрусловом потоке, хомингослаблен.
В дальнейшем история лососевых водоемов Дальнего Востока складывалась неодинаково. Территории материкового побережья Охотского моря и Камчатки в среднем плейстоцене подвергались довольно мощным оледенениям. В связи с воздействиемледников и общим похолоданием климата произошло обеднение видового состава пресноводных ихтиоценов. В этот период численность кетырезко сократилась, в первую очередь вследствие элиминации ранней формы, нерестилища которой подверглись значительным промерзаниям. Кета, воспроизводство которой происходило на выходах грунтовых вод, на материковом побережье Охотского моря могла сохраниться лишь в виде отдельных вкраплений на территориях, не подвергавшихся оледенениям. Это участки рр. Кава, Яма и Гижига (Глушкова, 1984). Не было оледенений и в бассейнах таких крупных рек, расположенных на северо-востоке и юго-западе отрассматриваемой территории, как Анадырь, Пенжина и Амур. В этих водоемах наиболее теплолюбивые виды третичной фауны вымерли (Берг, 1962; Цепкин, 1967), но элиминации форм кеты не происходило. После последнего (менее мощного) оледенения в позднем плейстоцене и потепления климата в реки материкового побережья Охотского моря и Камчатки произошло вторичное заселение кеты, причем иммиграция, вероятно, шла в двух направлениях: из Анадыря через затопленный в период регрессии океана Парапольский дол (Савин и др., 2009) и Пенжины с северо-востока и из Амура с юго-запада. В зоне интерградации происходило смешение аборигенных и аллохтонных форм, что и обусловило столь пеструю картину генетической неоднородности в популяциях кеты материкового побережья Охотского моря и Камчатки, которую мы и наблюдаем сейчас (Викторовский и др., 1988; Медников и др., 1988; Царев, 1990). Популяции кеты pp. Яма и Тауй, где в период оледенений могла сохраниться поздняя форма, в настоящее время являются наиболее гетерогенными (Викторовский и др., 1986). Экологическая и генетическая неоднородность кеты по ареалу связана с разнообразием условий воспроизводства. Наиболее благоприятные условия для формообразования складывались в крупных речных системах благодаря широкому спектру климатических, гидрологических и гидрогеологических характеристик водоемов. Хорошо известно осуществовании двух четко обособленных группировок кеты, различающихся сроками нерестового хода, выраженностью брачного наряда и протяженностью нерестовых миграций в бассейнах крупнейших лососевых рек Дальнего Востока и Северной Америки, таких как Амур и Юкон (Берг, 1953; Gilbert, 1924; Dymond, 1939). Кроме того, в сезонных расах амурской кеты выделяются биологически неоднородные локальные стада, приуроченные к крупным притокам (Бирман, 1956, 1977; Световидова, 1961). Междулетней и осенней расами амурской кеты имеются достоверные различия по биологическим характеристикам, кариотипам, генным частотам белков (Григо, 1953; Бирман, 1956; Куликова, 1971; Омельченко, 1985).
В то же время в бас. р. Анадырь преобладает кета, размножающаяся в основном на выходах грунтовых вод, — до 80—90% (Путивкин, 1986, 1989). Незначительная численность ранней формы кеты в крупнейшей реке СевероВостока Азии, на наш взгляд, объясняется двумя причинами: 1) в среднем и нижнем течении Анадыряложе реки имеет корытообразную форму без четко выраженных элементов русла — «плес — перекат», и практически нет участков, которые по составу грунтов и гидрологии подходят для размножения этой формы; 2) в притоках Анадыря и его верхнем течении эффективному воспроизводству ранней формы кеты препятствуют промерзание нерестилищ из-за низких атмосферных температур и слабый зимний сток — 1—4% годового (Кузнецов А.С., 1960, Глотов, Глотова, 2010). Вследствие этих причин численность горбуши и ранней кеты в р. Анадырь крайне низка.
В реках меньшей протяженности (до 300—400 км), где набор условий достаточно разнообразен или они значительно различаются по гидрологии (как, например, в бас. р. Тауй), также известны симпатрические группировки кеты, отличающиеся сроками и местами размножения. Несколько внутривидовых форм кеты описано для средних по величине рек Камчатки (Абрамов, 1948; Бирман, 1964), летне- и осенненерестующая кета обитает в реках Сахалина (Гриценко и др., 1987). Как правило, в реках этой категории преобладает поздняя формакеты.
Малые реки занимают по территории довольно узкую климатогеографическyю зону. Условия воспроизводства кеты в них, как правило, не отличаются большим набором микроусловий, вероятность экологической дивергенции и обособления форм гораздо меньше. Преобладающей формой кеты, населяющей мелкие реки, является ранняя. Русла малых рек разработаны слабо, мощность водоносных пластов в их долинах незначительна. Поэтому количество участков с постоянно высоким дебитом грунтовых вод в бассейнах этих рек крайне ограничено. Это и определяет низкую численность размножающейся в них ключевой кеты.
В распределении форм кеты по азиатской части ареала прослеживается закономерность: доля ранней кеты уменьшается в направлении с юга на север, что, по-видимому, обусловлено климатическими факторами.
Очевидно, наблюдаемое по ареалу разнообразие внутривидовых форм кеты является результатом микроэволюционных процессов в популяциях, происходивших на основе симпатрической дивергенции и экологической радиации, однако в отдельных регионах не следует исключать и аллопатрические варианты формообразования.
В зависимости от условий среды и стадии формообразовательного процесса степень различий морфобиологических характеристик и генетической дивергенции форм кеты может изменяться в значительных пределах. Поэтому в разных водоемах отмечается различный уровень внутривидовой дифференциации — от биотопических группировок дохорошо обособленных сезонных рас. Известно, что кета — филогенетически относительно молодой монотипический вид, являющийся наиболее крупной менделеевской популяцией и состоящий из множества локальных популяций, которые находятся друг с другом в определенных отношениях, а их особи потенциально в состоянии обмениваться генами в потомстве. Иерархические отношения в системе вида формируют его популяционную структуру. Его структура представлена популяциями разного размера, конфигурации и численности. Под популяционной структурой понимаются существование прочных, относительно устойчивых связей и взаимодействия популяций внутри вида (Грант, 1980; Глубоковский, 1987). Другими словами, популяционную структуру вида можно определить как множество локальных популяций, или демов, которые находятся друг с другом в соподчиненных отношениях (Майр, 1974). Изменяют и формируют популяционную структуру видов факторы эволюции: естественный отбор, миграция и дрейф генов (Тимофеев-РесовcKMn M J?p., 1973; SH6JIoKoB, FOcyqboB, 1976; AnAJIa, 1984; AJITyxoB, 1989; Dobzhansky, 1970). Количество популяционных группировок, их границы и объем входят в понятие популяционного состава вида, изучение которого всегда предшествует изучению его популяционной структуры (Глубоковский, 1995).
Исследования популяционной структуры видов привлекают к себе внимание биологов самых разнообразных специальностей. Не является исключением кета. Оттого, насколько полнопредставляем мы ее видовую структуру, зависит решение целого ряда теоретических и практических задач: проблемы микросистематики и биогеографии, вопросы управления ресурсами и стратегии развития рыбохозяйственного комплекса. За последние десятилетия накоплен большой материал, который позволил отметить ярко выраженную географическую дифференциацию кеты. На основании генетических характеристик кета подразделяется на североамериканскую и азиатскую (Варнавская, 2006; Okazaki, 1983; Beacham et al., 1987). К настоящему времени известно, что азиатская кета дифференцируется на ряд региональных суперпопуляций или региональных комплексов: восточного и западного побережий Камчатки, Сахалина, Приморья, Японии (Викторовский и др., 1986, Салменкова и др., 1986; Алтухов и др., 1997; Варнавская, 2006; Савин и др., 2009; Okazaki, 1983; Beacham et al., 1987). Североохотоморские популяции наиболее близки по своим генетическим параметрам к камчатской кете (Викторовский и др., 1986; Салменкова и др., 1986; Бачевская, 1990, 1992; Алтухов и др., 1997).
С помощью аэровизуальных, прямых визуальных наблюдений, исследований морфобиологических, генетических, фенетических признаков, сроков нерестового хода, биологической структуры, динамики численности выделены несколько локальных стад североохотоморской кеты (Клоков, 1975; Бачевская, 1983, 1990, 1992, 2002; Волобуев, 1990; Черешнев и др., 1992, Алтухов и др., 1997; Волобуев, Волобуев, 2000; Агапова и др., 2002; Волобуев и др., 2005а; Volobuev, 1999). Они приурочены к соответствующим районам воспроизводства, отличающимся друг от друга своеобразием гидрологических, гидрогеологических и гидрохимических условий. В свою очередь, локальные стада состоят из популяций, имеющих разную степень сходства и обособленности морфобиологических, генетических, фенетических показателей. Для ряда популяций кеты материкового побережья Охотского моря характерна темпоральная гетерогенность (Правдин, 1940; Костарев, 1970в; Бачевская, 1983, 1990, 1992, 2002; Волобуев, 1983a, 1984, 1986; Медников и др., 1988; Волобуев и др., 1990; Макоедов, Бачевская, 1992).
Изучение популяционной структуры североохотоморской кеты приобретает еще больший интерес помере накопления многолетних данных, полученных разными методами исследований. Только в процессе интеграции имеющихся в настоящий момент сведений могут сложиться полноценные адекватные представления о популяционной организации вида, которые имеют первостепенное значение в оценке сырьевых запасов и составлении обоснованных прогнозов возможных уловов. Вопросы дифференциации нагульных стадлососей и оценка их региональной принадлежности в последнее время становятся все более остро в связи с проблемами международного рыболовства и развивающегося искусственного воспроизводства кеты. Поэтому и предпринята попытка определить популяционную организацию кеты на исследованном участке ареала,
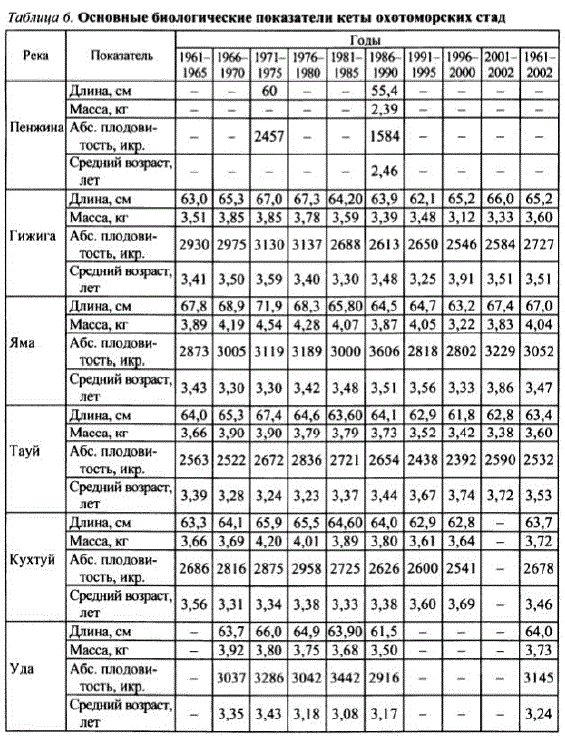
По комплексу биологических признаков и динамики численности на материковом побережье Охотского моря были выделены (Клоков, 1975, 1976) четырелокальные группы популяций (пареньская, гижигинская, ямская итауйская). В своей работе автор подразумевал, что, например, пареньская популяция несет все признаки пенжинского локального стада. Современные представления о внутривидовой структуре кеты региона позволяют считать, что правильнее говорить не о пареньской популяции, а о пенжинском локальном стаде, которое включает в себя эту популяцию. Пенжинская кета резко выделяется среди охотоморских полуляций наименьшими размерами иллодовитостью (табл. 6), а также генетическими показателями (Клоков, 1976; Бачевская, 1990, 1992: Черешнев и др., 1992). Кроме того, географически, по биологическим признаками динамике численности на Охотоморском побережье четко обособлены еще два локальных стадакеты: охотское иудское (см. табл. 6). Они включают группы западных популяций Охотского и Тугypo-Чумиканского районов.
Кета выделенных стад различается между собой по биологическим характеристикам (возрастная и размерно-весовая структуры, абсолютная плодовитость, упитанность), признакам внешней морфологии, генным частотам основных ферментных систем (Клоков, 1975, 1976; Бачевская, 1990, 1992; Волобуев и др., 1992; Волобуев, Волобуев, 2000), а также подинамике численности и уровням нерестовых подходов.
Наибольшими размерно-весовыми показателями и абсолютной плодовитостью выделяется ямская, а наименьшими — тауйская кета. Кета разных стад отличается и посреднемноголетним показателям возрастного состава подходов: доля рыб доминирующей возрастной группы (3+) варьирует от 48,3 (охотское стадо) до 62,8% (удское стадо). Упитанность охотоморской кеты колеблется от 0,76 до 2,61. Средний коэффициентупитанностикеты всех стад снижается от начала к концу хода с 1,53—1,49 до 1,40—1,37. Максимальной упитанностью выделяется кета тауйского стада, затем идет кета ямского и охотского стад. Наименьшей упитанностью характеризуются популяции кеты гижигинского иудского стад. Кета ранней и поздней форм также различается по упитанности: упитанность поздней кеты выше (Волобуев, Волобуев, 2000). Таким образом, по указанным признакам на материковом побережье Охотского моря можно выделить шесть относительно изолированных друг от друга локальных стадкеты: пенжинское, гижигинское, ямское, тауйское, охотское иудское. При этомтауйское стадо включает группу нерестовых популяций кетырек, впадающих в Тауйскую губу, гижигинское стадо — популяции рек Гижигинской губы и т.д.
При исследованиях популяционной структуры вида, наряду с анализом основных биологических показателей, интерес представляет изучение морфологического облика особей.
Таблица б. Основные биологические показатели кеты охотоморских стад
Известно, что реализация генетически закрепленного фенотипа происходит под влиянием абиотических факторов среды (Медников, 1962; Куликова, 1972; Коновалов, Шевляков, 1980; Иванков, 1997; Иванова, Свирская, 2002; и др.) и в случае отсутствия более или менее постоянного обмена мигрантами между разными участками нерестового ареала различия, формируемые под воздействием тех или иных факторов среды, постепенно закрепляются и усили
BBAKOITCH
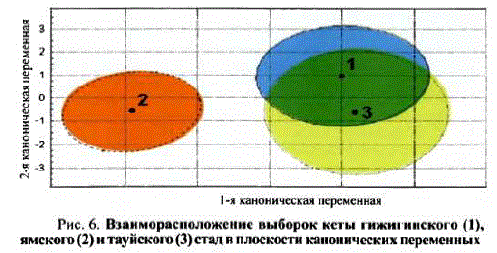
При исследовании географической изменчивости морфологического обликамы провели сравнительный анализ экстерьеракеты гижигинского, ямского и тауйского стад. Поскольку в алгоритмах дискриминантного анализа используется вычисление обратной матрицы, то для предупреждения формирования плохо обусловленной или вырожденной матрицы перед проведением расчетов мы удалили все тесно скоррелированные морфометрические признаки. В результате из 24 пластических промеров были оставлены 16 признаков. В ходе дискриминантного анализа с пошаговым включением переменных построена модель, наглядно иллюстрирующая положенис выборок в плоскости канонических переменных (рис. 6).
Рис. 6. Взаиморасположение выборок кеты гижигинского (1), ямского (2)нтнуйского (3) стад в плоскости канонических переменных
Степень различий между стадами поморфологическому облику оценивали при помощи расстояния MaxaJIaHo6Mca D, отражающего удаленность центроидов выборок друг от друга в многомерном пространстве канонических переменных. На наимсньшем расстоянии друг от друга располагаются центроиды выборок кеты гижигинского и тауйского стад — 2,65 D:(F = 23,67, p<0.001), тогда как расстояние между центроидами соселних стад — гижигинскими ямскими ямскими тауйским — значитсльно больше и составляет соответственно, 36,42 (F = 48,61, p < 0,001) и 38,54 (F = 52,91, p < 0001) D:(см. рис. 6, табл. 7).
Таким образом, наибольшим морфологическим сходством, которое, повидимому, обусловлено наличием общих независимо приобретенных фенотипиHCCKHX xapaKTepMcTMK (сходство, OHeBHHO, HMT конвергентный характер), характеризуется кета территориально удаленных стад: гижигинского и тауиского, а наименьшим соседних стад: гижигинского и ямского и ямского и тауйского. Тем не менее анализ F-значений ир-уровней расстояний Махаланобиса позволяет нам с определенной долей уверенности говорить о том, что кета исследованных стад достоверно различается поморфооблику, так как, во-псрвых, р-уровни во всех случаях превышают 0,001%-ный порог значимости, а, вовторых, уровень внутригрупповой дисперсии (16,62) во всех случаях ниже расчетных F-значений.
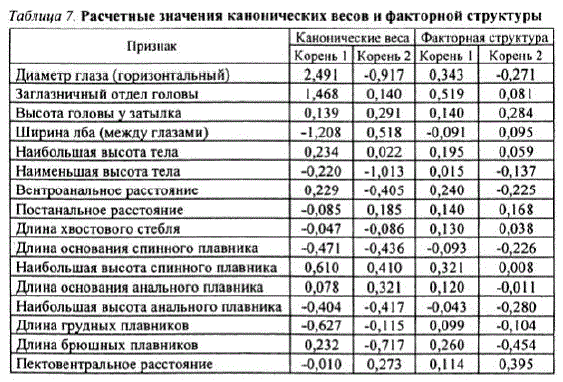
Наибольший вклад в дифференциацию стад по признакам внешней морфологии вносят такие признаки, как горизонтальный диаметр глаза, длина заглазничного отдела головы, а также высота головы у затылка и длина брюшных плавников — признаки, которые, с одной стороны, обладают наибольшим каноническим весом, а с другой — имеют наибольшую связь с дискриминирующими функциями (см. табл. 7).
Таблица 7. Расчетные значения канонических весов и факторной структуры
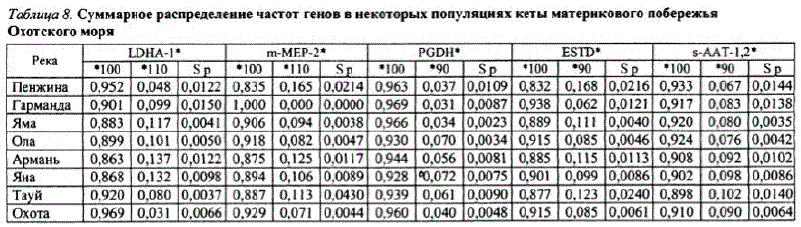
С помощью биохимических методов исследования и оценки изменчивости частот гаплотипов митохондриальной ДНК, как уже отмечалось, было определено, что среди дальневосточных популяций кета североохотоморского побережья имеет ярко выраженную генетическую обособленность, хотя в некоторых случаях обнаружено сходство с популяциями кеты Камчатки и даже Чукотки. В свою очередь, североохотоморские популяции подразделялись на три группы. В первую объединились три близкорасположенные популяции pp. Яма, Ола, Тауй, во вторую вошли географически более отдаленные популяции рр. Гарманда и Охота. Пенжинская кета отличалась от всех популяций обеих групп (Викторовский и др., 1986; Салменкова и др., 1986; Бачевская, 1990, 1992). Дальнейшие исследования были направлены на более глубокое изучение внутрипопуляционной структуры кеты. Впервые были исследованы популяции кеты рр. Армань, Яна (Bachevskaya et al., 2000) и продолжено изучение взрослойкеты других рек континентального побережья Охотского моря: Охоты, Тауя, Олы, Ямы, Гарманды, Пенжины. Суммарные значения частот генов, полученные по исследованным локусам, представлены в табл. 8.
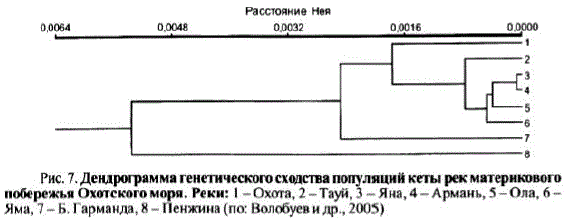
Дендрограмма, построенная на основании генетического расстояния Нея, показывает, что кета данного региона образует несколько кластеров, выделяющихся на разных уровнях сходства популяций (рис. 7).
Как отмечалось ранее в других подобных исследованиях (Бачевская, 1992), пенжинская кета значительно отличается от всех исследованных нами популяции. Она выделилась в отдельный кластер и обнаружила минимальное сходство с другими исследованными популяциями кеты. Несмотря на географическую удаленность охотской и гармандинской кеты друг от друга, они имеют наибольший уровень генетической близости. Такое сходство может иметь либо случайный характер из-за небольшой выборки изученных генов, либо сходство носит конвергентный характер вследствие сходства условий среды обитания на разных стадиях онтогенеза, что отражается в адаптации по исследован
ным генами определяет высокий уровень их генетической близости. Другой причиной может быть недостаточность изученностигармандинской популяции, которая, в отличие от охотской кеты, представлена пока единичными выборками. Возможно, по мере накопления генетических данных, она займет другую позицию в дендрограмме сходства. Среди последних двух популяций по генетическим показателям гармандинская кета более сходна с тауйской. Тауйская кета имеет различную степень сходства сольской, ямской, арманской и янской популяциями. Между производителями арманской и янской кеты, образующими одну группу, наблюдается полное генетическое сходство. К ним присоединяется ямская кета, географически более удаленная, чем тауйская и ольская. Исследования предыдущих лет показывали, что генетическое сходство между популяциями рр. Тауй, Яма, Ола очень велико, но больше все же оно проявлялось между тауйской и ямской кетой (Викторовский и др., 1986; Салменкова и др., 1986; Бачевская, 1990, 1992; Алтухов и др., 1997). В настоящее время ямская кета больше сходна сольской, а ольская стауйской. Таким образом, мы видим, что к настоящему времени местоположение некоторых популяций в дендрограмме генетического сходства изменилось. Это могло произойти в силу ряда причин. Например, в связи с тем, что все эти популяции подвержены влиянию искусственного воспроизводства, и это могло сказаться на генетической структуре каждой из них.
С помощью различных методов было установлено, что ряд популяций североохотоморской кеты имеют высокий уровень темпоральной гетерогенности (Правдин, 1940, Костарев, 1970в, Бачевская, 1983, 1990, 1992; Волобуев, 1983a, 1986; Викторовский и др., 1986; Салменкова и др., 1986; Медников и др., 1988, Волобуев и др., 1990, 1992; Макоедов, Бачевская, 1992; Макоедов, 1999).
Авторы имеют неодинаковые взгляды на причины, вызывающие неоднородность кеты разных сроков нерестовой миграции. Многие не исключают, что одной из них может быть
наличие сезонных рас. По биологическим показателям ранняя и поздняя формы североохотоморской кеты существенно отличаются: средняя масса ранней кеты на 0,5—0,7 кг, а длина на 3—4 см меньше, чему доминирующей поздней кеты (Волобуев, Голованов, 2001).
Рис. 7. Дендрограмма генетического сходства популяций кеты рек материкового побережья Охотского моря. Реки: 1 — Охота, 2 — Тауй, 3 — Яна, 4 — Армань, 5-Ола, б — Яма, 7 - Б. Гарманда, 8 - Пенжина (по Волобуев и др., 2005)
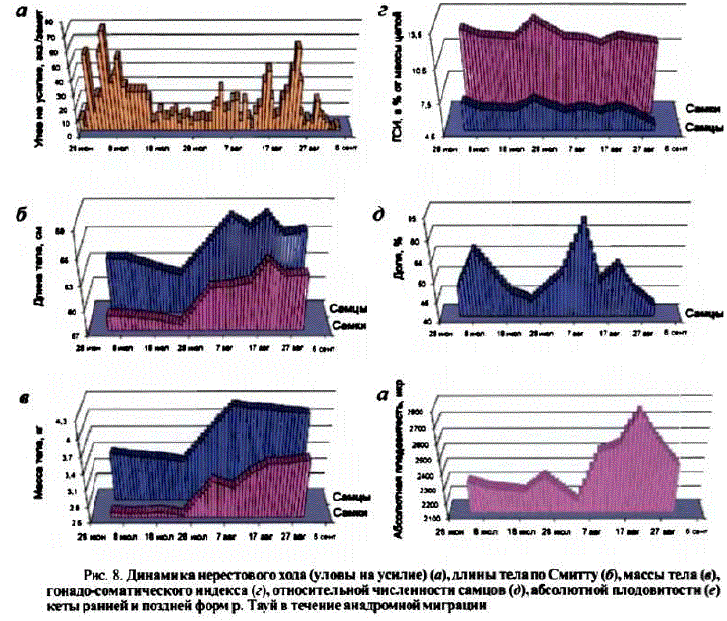
Кста ранней и поздней форм отличается также степенью развития гонад, абсолютной плодовитостью и соотношением полов в течение анадромной миграции. У ранней формы икра более мелкая, поэтому у рыб одного размера, относящихся к разным сезонным расам, более высокую плодовитость имеет ранняя кета (Волобуев, 1984, 1986; Медников и др., 1988; Волобуев и др., 1990, 1992; рис. 8).
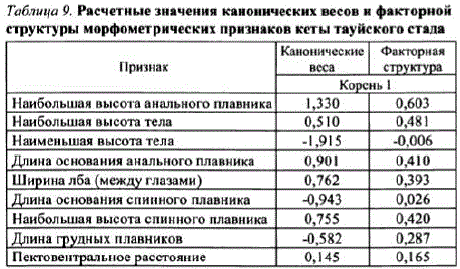
Ранняя и поздняя кета различаются сроками и местами нереста (Волобуев, Волобуев, 2000), а также достаточно четко различаются по экстерьерным признакам. Например, расстояние Махаланобиса между центроидами ранней и поздней форм кеты р. Тауй, равняется 4,16 (F = 12,50, p < 0,001), а величина F-значения больше уровня внутригрупповой дисперсии, равной 9,11. Экологичсские формы кеты различаются нерестовыми биотопами, поэтому основной вклад в разграничение форм вносят признаки, формирующиеся под влиянием температуры (длина основания анального плавника), глубины (наибольшая высота спинного и анального плавников, наибольшая высота тела) и скороститечения на нерестилищах (ширина лба) (табл. 9).
Таблица 9. Расчетные значения канонических весов и факторной структуры морфометрических признаковкеты тауйского стада
Методом молекулярной гибридизации ДНК среднеповторяющейся фракции с последующим анализом термостабильных гибридных дуплексов установлено, что в популяции р. Тауй, в которой симпатрично обитают две формы кеты — ранняя и поздняя, выделяются два нетрансгрессирующих уровня дивергенции, соответствующие этим формам.
Между популяциями ранней и поздней кеты существует обмен генами в пределах до 10%, тем не менее выявленные сезонные группировки поддерживают свою самостоятельность и присущие им морфобиологические характеристики (Медников и др., 1988).
Исследования, проводимые с помощью методов биохимической генетики, позволили обнаружить генетическую неоднородность выборок производителей тауйской кеты практически повсем исследованным полиморфным ферментным системам. При этом следует отметить, что в разные годы она наблюдалась по различным локусами наиболее рельефно проявилась по ESTD* и s-AAT 1, 2* (Бачевская, 2002). При парном сравнении выборок кеты одного года отличия зачастую проявлялись между выборками кеты, относящимися к разным сезонным группировкам, но в некоторых случаях они обнаруживались и между выборками одного срока нерестовой миграции. Например, по ESTD* были обнаружены отличия между производителями тауйской кеты от 08.07.94
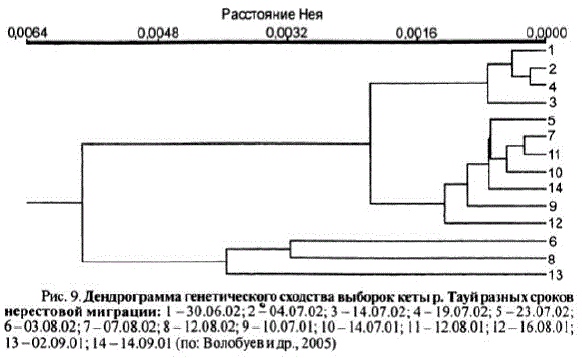
h 24.08.94, X?= 6,73**; 25.07.95 - 24.08.95, X? = 3,996*; 16.07.99 h Bce nocnemyKoure: 22.07.99, X2 = 6, 18*; 03.08,99, X? = 5,96*; 15.08.99, X2 = 8,95**; 25.08.99, Х" = 10,06**; выборка 05.07.00 отличалась от выборки 05.08.00, Х* = 8,20**, a Takoke or 10.08.00, X = 9,97"; 10.07.00 or 05.08.00, X =6,93** Hot 10.08.00, Х" = 8,57**. По LDH-A1" отмечены отличия между производителями кеты, добытыми 10.07.96 и 26.07.96, Х" = 7,85**; 10.07.00 и 10.08.00, Х" = 6,29*. Достоверные отличия наблюдались и по другим локусам (s-AAT-1.2", PGDH". m-MEP-2"). Генетическая дифференциация, наблюдаемая между выборками одного времени нерестовой миграции, требовала объяснения. В Втих целях в 2001—2002 гг. был собран материал, более полно отражающий сроки нерестовой миграции тауйской кеты. Кроме того, впервые собран материал на нерестилищах ранней и поздней кеты. Как уже отмечалось, в бас, р. Тауй (образованном слиянием двух притоков — р. Кава равнинного тундрового типа и р. Челомджа горного типа) существуют две сезонные расы кеты. Ранняя нерестится в р. Кава, поздняя — вр. Челомджа (Волобуев, 1983a, 1984, Волобуев и др., 1990). Таким образом, тауйская кета имеет как временную, так и пространственную разобщенность. Для наглядного представления взаимоотношений тауйской кеты разных сезонных группировок проведен кластерный анализ. На основе полученных генетических расстояний Нея построены дендрограммы сходства (рис. 9).
Дендрограмма показывает, что исследованная кета распределилась в три кластера. Первый включает раннюю кету только одного (2002) года. Второй кластер объединяет выборки обеих сезонных группировок разных лет, включая производителей поздней кеты, добытых на нерестилище р. Челомджа. Третий кластер образован исключительно поздней кетой из выборок 2001 и 2002 г. Полученные результаты отчетливо показывают, что популяционно-генетическая структура кеты р. Тауй определяется наличием двух сезонных рас — ранней и поздней. Между ними имеются существенные генетические различия. Отметим, что они проявляются более контрастно в последние годы на фоне увеличения доли ранней кеты в общей численности тауйской кеты, что может быть еще одной причиной изменения ее положения в дендрограмме сходства североохотоморских популяций.
Ранняя кета, представленная выборками одного года, однородна. Поздняя кета, напротив, обнаруживает генетическую гетерогенность. Вполне вероятно, что поздняя кета заходит на нерест не только в р. Челомджа, но и в р. Кава. То есть мы наблюдаем производителей единой сезонной расы, размножающихся в разных биотопических условиях. Если учесть, что одна из рек является горной, а другая принадлежит к типу равнинных тундровых реки условия размно
47
жения и развитие кеты на их нерестилищах очень отличаются, то возможно разнонаправленное действие естественного отбора. Возможно, результат такого отбора мы наблюдаем в виде генетических различий, проявляющихся между производителями поздней кеты.
Рис. 9. Дендрограмма генетического сходства выборок кеты р. Тауйразных сроков
нерестовой миграции: 1—30.06.02, 2 - 04.07.02; 3 — 14.07.02; 4 — 19.07.02,5—23.07.02,
6-03.08.02; 7-07.08.02; 8-12.08.02; 9-10.07.01; 10-14.07.01; 11 - 12.08.01; 12- 16.08.01; 13-02.09.01; 14 - 14.09.01 (no: Bonooyes Mrp., 2005)
На основании многолетних собственных исследований и результатов, полученных другими авторами (Клоков, 1970, 1975, 1976, Костарев, 1970а, б, Волобуев, 1983a, 1984, 1986; Бачевская, 1990, 1992; Волобуев, Тюрнин, 1995; Волобуев и др., 1990, 1992; Волобуев, Волобуев, 2000; Агапова и др., 2002; и др.), изучавшими биологическую, фенетико-генетическую, внутривидовую структуру, распределение по участку ареала, динамику численности и другие особенности кеты, считаем возможным представить свое видение популяционной структуры кеты, популяции которой воспроизводятся в реках материкового побережья Охотского моря. Мы присоединяемся к мнению других исследователей и считаем, что популяционная организация кеты вполне удовлетворительно описывается пространственной и биологической структурами.
Пространственная структура вида отражает особенности географического распределения особей по ареалу, топографию, границы и конфигурацию популяций и локальных стад, количество и объем популяционных группировок разного иерархического уровня. Согласно классификации распределения особей по ареалу (Одум, 1986), для лососей характерно групповое или, точнее, дискретно-групповое распределение в репродуктивном и нагульном участках ареала. В пределах бассейна реки или озерно-речной системы топография нерестилищ всех видов лососей, как правило, будет различаться, что обусловлено видоспецифичными требованиями каждого вида к условиям размножения. Границы и конфигурация нерестовых агрегаций лососей будут определяться наличием пригодных для размножения вида площадей и субстрата, гидрологическим режимом, численностью особей отдельных локальных нерестовых группировок, а также их общим количеством на участке ареала.
Биологическая структура включает сведения о морфологической, фенетической, генетической, экологической, трофической, размерно-весовой, возрастной, половой и других структурах для всех изученных популяций вида. Биологическая структура характеризует относительно устойчивые связи и взаимодействия на внутри- и межпопуляционном уровнях. Назначение биологической структуры видов заключается в выработке адаптаций к среде обитания. Различают два типа внутривидовой дифференциации: популяционную (собственно внутривидовую) и внутрипопуляционную (эпигенетическую) (Глубоковский, 1987, Василенко, 1994), которые могут существовать одновременно и независимо. Перестройка и трансформация популяционной организации вида занимает значительный промежуток времени, измеряемый периодами жизни многих поколений, эпигенетическая дифференциация проявляется в разнокачественности особей одной генерации в онтогенезе: вид может иметь несколько эпигенетических траекторий развития или вариантов реализации жизненной стратегии.
К таким онтогенетическим группировкам у кеты можно отнести особей с нарушениями типичного жизненного цикла, например, молодь, задерживающуюся назимув натальных водоемах (Волобуев, 1983б; Штундюк, 1987; Мегтit, Raymond, 1983) и скатывающуюся в море следующей весной в возрасте годовика.
Имеются сведения об озерном экотипе кеты — генеративно лимнофильной форме, размножение и нагул молоди которой проходит в озерах — оз. Краснено в бассейне Анадыря (Остроумов, 1967), оз. Сопочное на о. Итуруп (Иванков, 1984), оз. Лагунное, Песчаное и Алигер о. Кунашир (Иванков, Броневский, 1974, 1975; Каев, 1986), в оз. Нерпичье в бас. р. Камчатка (Бугаев В.Ф., 2007). Однако не исключено, что часть потомства кеты, воспроизводящейся в озерах, может возвращаться на нерест как в озера, так и в реки.
Другим примером эпигенетических вариантов развития может служить разновременность созревания у кеты рыбодного поколения, которые могут возвращаться на нерест в возрасте от 1 + до 6+ лет и обусловливать степень перекрывания и обмен генами между особями разных возрастных групп и поколений во времени и пространстве. Эпигенетические группировки являются формой реализации биологической структуры популяций. Сходство эпигенетических вариантов развития в разных популяциях или уродственных видов объясняется гомологической изменчивостью (Савваитова, 1969, Максимов, 1976; Bасиленко, 1994). Примером существования эпигенетических формирований улососевых могут быть нормально развивающиеся и карликовые (неотенические) группировки, планктофагии хищники, мигрирующие и резидентные формы и др., которые могут выщепляться в поколениях в течение одного жизненного цикла. Сумма знаний об этих параметрах в пределах ареала или участка ареала вида дает представление о его популяционной структуре.
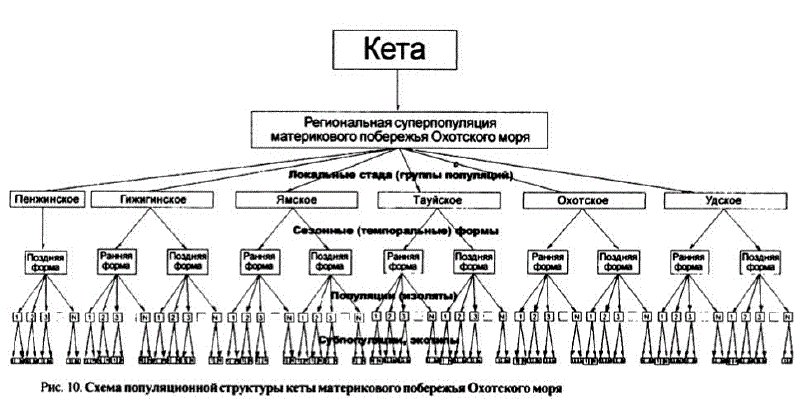
Рассмотрим популяционную структуру кеты материкового побережья Охотского моря на участке протяженностью более 3,5 тыс. км по линии берега от Удской до Пенжинской губы (см. рис. 1). Эта часть ареала подразделяется на ряд относительно изолированных локальных участков воспроизводства кеты, Выделение указанных районов воспроизводства основано на предположении, что природные физические преграды (водоразделы, полуострова, морские заливы) являются своеобразными барьерами, ограничивающими поток генов и обеспечивающими определенную степень изоляции. При этом учитывались различия поморфобиологическим признакам, срокам нерестового хода, возрастной и размерно-весовой структуре, динамике численности, наличие внутривидовых форм и др. (Клоков, 1975; Волобуев, 1990; Волобуев, Волобуев, 2000). Таким образом, выделены несколько групп популяций, или локальных стад, приуроченных к соответствующим районам воспроизводства, отличающимся друг от друга своеобразием гидрологических, гидрогеологических и гидрохимических условий. В связи с этим популяционную организацию кеты североохотоморского побережья можно представить в виде следующей блок-схемы (рис. 10).
Верхний уровень предлагаемой схемы занимает региональная суперпопуляция (региональный комплекс) кеты материкового побережья Охотского моря по аналогии с региональными комплексамилососей других районов происхождения — восточного и западного побережий Камчатки, Сахалина, Японии, Аляски, Британской Колумбии и др., подразделенных по принципу географической обособленности (Okazaki, 1983). Она имеет ярко выраженное генетическое своеобразие, хотя в некоторых случаях обнаруживается сходство с популяциями рек Камчатки и Чукотки.
Второй уровень занимают локальные стада (в понимании И.Б.Бирмана (1956, 1964), C.M. KoHoBaJIoba (1971, 1980), HO.II. AJITyxoBa(1974), B.H. MBaHKoва (1993), Б.М. Медникова с соавторами (1988), В.Ф. Бугаева (1995), П. Ларкина (Larkin, 1972), У. Рикера (Ricker, 1972) и др.), которые состоят из групп популяций (популяционных систем, изолятов), приуроченных к отдельным районам воспроизводства. Факторами, определяющими ту или иную степень изоляции локальных стад, являются природные физические преграды, которые служат своеобразными барьерами, ограничивающими поток генов и обеспечивающими определенную степень изоляции между локальными группировками. Естественно, между популяциями, входящими в состав локального стада, в той или иной мере должен существовать обмен генами, иначе само понятие популяционной системы теряет смысл. Совокупность популяций, изолятов, входящих в состав крупных речных систем или групп более мелких самостоятельных популяций, интегрированных в пределах какой-либо локальности, обычно принято называть стадами. В этом смысле можно говорить о нерестовых стадахкеты рр. Анадырь, Камчатка, Амур, или о локальных стадах кеты Пенжинской, Гижигинской, Ямской, Тауйской, Удской губ, включающих популяции нескольких групп нерестовых рек, расположенных на материковом побережье Охотского моря.
Третий уровень представлен сезонными или темпоральными формами кеты. Они аналогичны, но нетождественны летней и осенней расам амурской кеты и могут обитать как симпатрично в бассейне одной реки, таки раздельно в разных речных системах. В нашем случае это ранняя и поздняя по срокаманадромной миграции и размножения формы кеты, отличающиеся по местам нереста, размерно-весовым характеристикам, степени развития гонад, плодовитости и соотношению полов в течение анадромной миграции (Волобуев, 1983a, 1986; Волобуев и др., 1990, 1992; см. рис. 8). Кетаэтих сезонных форм обитает в популяциях удского, охотского, тауйского и ямского стад (Правдин, 1940; Костарев, 1970в; Волобуев, 1984, 1986; Волобуев и др., 1990). Документальных подтверждений осуществовании временных или сезонных форм в стадах, расположенных в северо-восточной части региона (Гижигинская и Пенжинская губа), к настоящему времени нет, однако имеются сведения о ранних (в июне) немногочисленных подходахкеты в р. Гижига (устное сообщение С.Л. Марченко). Как уже отмечалось, доля ранней кеты в нерестовых подходах снижается с продвижением на северо-восток побережья.
Четвертый уровень в нашей схеме занимают популяции, приуроченные к определенным речным бассейнам с характерными химическими, гидрологическими, гидрогеологическими и ценотическими условиями обитания и воспроизводства. Эти особенности во многом определяют хоминг, обеспечивающий необходимый уровень изоляции популяций в популяционных системах. Объем и численность воспроизводящихся в пределах стада единиц запасакеты различны. Таких устойчивых во времени и пространстве популяций кеты в пенжинском локальном стаде насчитывается 17, в гижигинском — 16, в ямском — 21, в тауйском — 8, в охотском — 14 и вудском — 5 (наши данные; Путивкин и др., 2001).
51
Численность производителей в нерестовых популяциях кеты, воспроизводящихся в реках побережья, существенно колеблется год от года и может составлять от 2—5 тыс. рыб в малых популяциях (pp. Малкачан, Б. Гарманда, Шилкан и др.) до 2—2,5 млн рыб в крупных водоемах (pp. Охота, Уда).
В пятый уровень можно выделить субпопуляции, или демы, кеты. Субпопуляции — это естественные самовоспроизводящиеся субъединицы вида, образующие в бассейне реки в определенной степени изолированные группировки, приуроченные к отдельным нерестовым участкам или притокам (Волобуев, 1990). Кроме того, у охотоморской кеты выделены два экотипа поместам размножения: русловой и ключевой (Волобуев, Рогатных, 1997). В некоторых случаях, как, например, в тауйском стаде кеты, понятие «субпопуляция» совпадает с понятием «экотип».
Отметим, что предлагаемая нами схема популяционной структуры кеты материкового побережья Охотского моря имеет генерализованный вид и не претендует на законченность. По мере накопления новых данных она может уточ
Таким образом, кета как вид представляет собой сложноорганизованную многоуровневую популяционную систему. Наличие внутривидовой подразделенности позволяет виду осваивать обширный ареал, адаптироваться к разнообразным условиям среды обитания и воспроизводства в виде озерных, речных и ключевых экотипов. Образование устойчивых во времени и пространстве экологических форм обусловливает закрепление их на генетическом уровне (Hoвосельская и др., 1982, Алтухов и др., 1983, Варнавская, 1983; Омельченко, 1985; Ильина, 1987а, б). Адаптационные особенности поместам размножения, выработанные в филогенезе, обусловили расхождение по срокам нерестового хода, что привело к образованию темпоральных форм различной степени выраженности, вплоть до хорошо обособленных сезонных рас практически у всех видов тихоокеанских лососей: симы (Иванков, Свирский, 1976; Семенченко, 1983, 1989), кижуча (Смирнов А.И., 1975; Зорбиди, 1983, 1990, Ковтун, 1994), чавычи (ВронcKHri, 1972, 1983; Slater, 1963; Kjelson et al., 1982; Kwain, Thomas, 1984), Hep KH (Куренков, 1977; Коновалов, 1980; Вецлер, Горшков, 1985; Глубоковский, 1995, Burgner, 1991), горбуши (Иванков, 1967а; Алтухов и др., 1983; Омельченко, 1985; Ефанов, 1989), кеты (Бирман, 1964; Салменкова и др., 1986; Николаева, ОвчинHHKOB, 1988; OBuHHHHKoB, Makoelo B, 1994; Salo, 199l; Volobuev, 2000).
Помимо межпопуляционных различий, для тихоокеанских лососей, и для кеты в частности, характерна внутрипопуляционная разнокачественность по признакам внешней морфологии, биологическими фенотипическим показателям, полиморфизмучастоталлелей тех или иных локусов, уровню гетерозиготности, нерестовым биотопам и др. (Андреев, Никулин, 1977; Бирман, 1977; Черешнев, 1980; Семенченко, 1983, 1989; Алтухов и др., 1983, 1997; Бачевская, 1990, 2002; Царев, 1990; Макоедов, Бачевская, 1992; и др.).
Гомеостаз популяционных систем определяется целостностью сложившейся биологической структуры стада. В случае упрощения популяционной структуры, сокращения количества слагающих ее элементов, очевидно, сужается адаптивная норма реакции как отдельных структурных элементов, так и всей популяционной системы вида в целом. Сложноструктурированные системы более устойчивы во времени и пространстве по отношению к популяционным системам с относительно простой структурой.
Сложноструктурированные системы обладают более совершенными компенсационными свойствами и способны поддерживать свои численность и разнообразие даже при резких изменениях условий среды. Так, например, кета по отношению к горбуше является более сложноорганизованным видом, который
52
более ровно, сглаженно реагирует на изменения внешних факторов таких, как нарушения условий воспроизводства, пресс промысла и др.
Таким образом, кета, как и все лососирода Oncorhynchus, является монотипическим полиморфным видом. Многокомпонентность вида в форме существования нескольких (Берг, 1948; Бирман, 1964; Николаева, Овчинников, 1988; Кузищин, 2010) форм (рас, экотипов) следует рассматривать как адаптацию к условиям обитания или как различные варианты реализации жизненной стратегии, повышающие его выживаемость и стабильность во времени и пространстве как популяционной системы. Встречающиеся по ареалу формы кеты следует рассматривать как внутривидовые группировки разной иерархии, крайним вариантом внутривидовой дифференциации которых на современном этапе являются сезонные экологические формы,
При рассмотрении популяционной организации кеты мы исходим из положений концепции «локального стада», предусматривающей иерархичность популяционных систем, высокую степень хоминга и приуроченность возвратов лососей в конкретную географическую местность. Концепция локального стада в абсолютном большинстве случаев удовлетворительно объясняет и свысокой степенью достоверности позволяет прогнозировать периодические изменения численностилососей как в отдельных регионах, так и в целом по Дальнему Востоку. Распределение промысловых усилий соразмерно численноститемпоральных группировок позволяет поддерживать численность стади создает предпосылки к сохранению биологического разнообразия внутривидовых форм. На принципах моделилокального стада основана система представления краткосрочных и перспективных прогнозов оценки возвратов, стратегия управления и рациональная эксплуатация запасов лососей.