Материал и методики
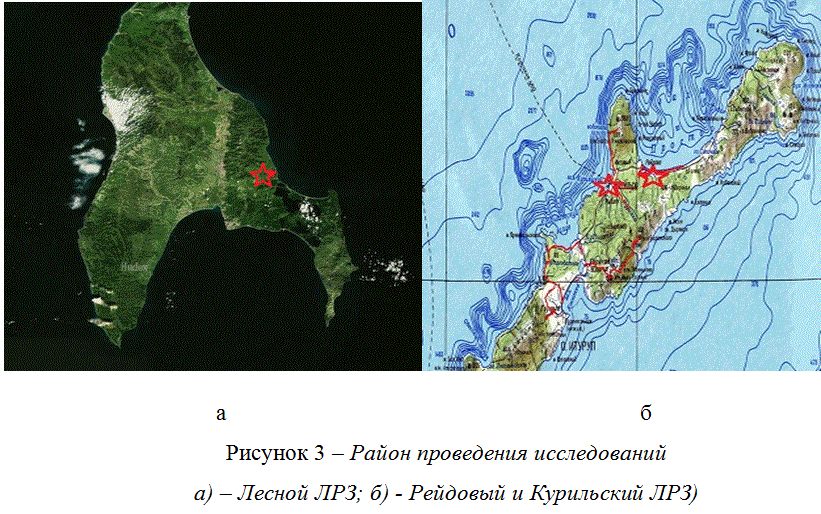
В основу работы положены материалы исследований, проведенные с 1990 по 2012 г. на ЛРЗ Курильский и Рейдовый, расположенных на острове Итуруп Курильской гряды и ЛРЗ Лесной – в Корсаковском районе Сахалинской области (Рисунки 3а и 3б).
а б
Рисунок 3 – Район проведения исследований
а) – Лесной ЛРЗ; б) - Рейдовый и Курильский ЛРЗ)
В качестве объектов исследований использованы горбуша (Oncorhynchus gorbusсha Wallbaum, 1869) и кета (O. keta Wallbaum, 1869) на разных этапах онто-генеза (эмбрионы, предличинки, личинки, молодь и половозрелые особи) в усло-виях искусственного воспроизводства.
Измерение параметров среды во время прохождения стадий онтогенеза гор-буши и кеты проводили в условиях производственных предприятий. Температуру воды измеряли три раза в день: в 9:00, 14:00 и в 18:00, отдельно для каждого из видов, используя термометр ртутный стеклянный лабораторный TL (всего обра-ботано 106 380 измерений). Содержание растворенного кислорода контролирова-ли три раза в день (используя термооксиметр) в период выдерживания производи-телей в садках, и при выращивании молоди, а также ежедекадно в процессе инку-бации, выдерживания предличинок и подращивания личинок (всего обработано 61 776 показаний). Расход воды в период инкубации икры, выдерживания пред-личинок и подращивания личинок измеряли ежедекадно, во время выдерживания производителей горбуши и кеты в садках и выращивания их молоди - два раза в день. Расход воды в единицу времени в инкубационных аппаратах и питомных каналах определяли расчетным методом, на основании пропускной способности водоподающих труб, снабженных шаровыми кранами (всего обработано 41 976 данных).
При непосредственном участии автором был собран материал в период с 1994 по 1999 год на ЛРЗ Рейдовом, с 2009 по 2012 год – на ЛРЗ Лесном, с 2009 по 2013 гг. – работая в СахГУ.
Градусодни (гр/дн) считали, как сумму тепла, накопленную организмами за время развития.
Для измерения абиотических параметров среды применяли следующее обо-рудование:
• для измерения температуры воды применяли термометр ртутный стек-лянный лабораторный TL в оправе Фусса (от 0 до 50°С, цена деления 0,1°С); мак-симальная глубина измерения – 5 м. Измерение проводили следующим образом: термометр опускали в воду, 2–3 раза воду набирали в стакан и сливали. После термометр опускали в вертикальном положении в воду на 5 минут, поднимали до уровня глаз и по шкале определяли температуру воды;
• термооксиметр «Horyba» японского производства, с цифровым жидкок-ристаллическим индикатором, предназначенный для оперативного измерения со-держания растворенного кислорода и температуры воды непосредственно в водо-еме. Технические характеристики термооксиметра приведены в приложении.
Биологический анализ производителей и молоди выполняли по стандартной методике измерения лососевых рыб [112]. Во время биологического анализа со-бирали отолиты, согласно «Методике массового маркирования отолитов» [1; 155].
Для определения количества икринок в навеске взвешивали обе гонады, за-тем из середины одной из них брали навеску в 20 г для горбуши и 50 г для кеты и просчитывали в ней количество икринок. После этого пересчитывали количест-во икринок на всю массу гонад и, тем самым, рассчитывали величину абсолютной плодовитости самки лососей в конкретное время хода. После определения плодо-витости 50-ти самок определяли среднюю плодовитость на момент отбора пробы. Для определения популяционной плодовитости, определение индивидуальной производили трижды во время нерестового хода: в начале, середине и конце. По-лученные значения взвешивали на долю особей в каждом из подходов и тем са-мым получали средневзвешенное значение плодовитости, которое, в большинстве случаев, можно принять за популяционную плодовитость.
Рабочую плодовитость определяли во время сбора половых продуктов. Её значение равно абсолютной за вычетом икринок невыметанных или недозрев-ших, оставшихся в брюшной полости.
Возраст производителей кеты определяли по чешуе. Пробы чешуи для оп-ределения возраста брали во втором—третьем ряду выше боковой линии за вертикалью, проходящей сзади спинного плавника.
Биологический анализ икры выполняли по следующей схеме: набирали 100 икринок одной партии из разных инкубационных аппаратов в чашку Петри, обя-зательно закрывая крышкой во избежание высыхания. Биологический анализ ик-ры проводили на 3-х стадиях развития:
– оплодотворенной икры;
– после набухания;
– перед выклевом.
Количество икринок в каждой пробе – не менее 100 штук. Пробы брали от-дельно из первой, средней и последней партий сбора в течение всего периода на-блюдений. Анализ включал в себя: А/Д икры – диаметр икринки в мм; Б/Р икры – вес икринки в мг.
Диаметр икринки определяли с помощью окуляр – микрометра МБС-9 или «методом средних». На миллиметровую металлическую линейку укладывали плотный ряд из 10 икринок и определяли их суммарный диаметр (Рисунок 4). Среднее значение из суммарных диаметров 100 икринок дает размер диаметра икринки в пробе.
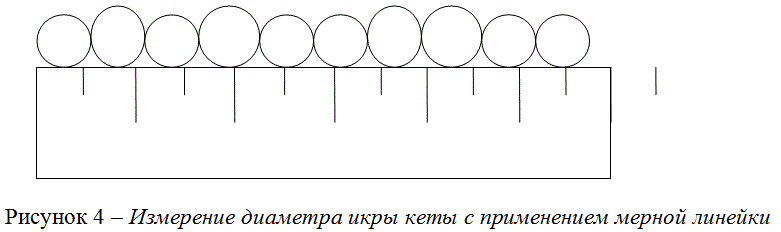
Рисунок 4 – Измерение диаметра икры кеты с применением мерной линейки
Вес икры определяли как средне взвешенную величину из 100 икринок. Взвешивание производили на электронных весах «Sartorius». Технические харак-теристики весов представлены в таблице 4 Приложения В. Данные заносили в журнал биологических анализов икры, где указывали вид рыбы, дата анализа, место взятия пробы (№ аппарата), номер партии, количество градусодней.
Биологический анализ свободных эмбрионов и личинок. Частота проведения анализа – 1 раз в месяц. Количество эмбрионов в пробе 100 штук. Пробы брали от первой, средней и последней партий сборов, причем от одних и тех же в тече-ние всего рыбоводного цикла. Пробу отбирали в различных местах питомного ка-нала. Свободных эмбрионов и личинок фиксировали следующим образом: пробу помещали в стакан с 4 % раствором формалина на 15–20 минут, после чего личи-нок промывали в чистой воде, обсушивали в марлевой салфетке и сразу произво-дили промеры и взвешивание. При длительном выдерживании пробы в формали-не может наблюдаться искажение весовых данных, по этой причине пробы фик-сировали не более 15–20 минут. Перед измерениями свободного эмбриона и личинку расправляли, так как в растворе формалина форма тела может дефор-мироваться. Определяли следующие параметры свободных эмбрионов (Рисунок 5) и личинок: длина АС в мм, длина АД в мм, общий вес в мг и вес желточного мешка в мг. Весовые показатели определяли на электронных весах «Sartorius» с точностью до 1 мг (Таблица 1 Приложения В).
Рисунок 5 – Измерение длины свободного эмбриона кеты
Желточный мешок перед взвешиванием отделяли от личинки с помощью препаровальной иглы или скальпеля. Работу по отделению желточного мешка проводили очень внимательно, тщательно отделяя желточный мешок от кожного покрова и внутренних органов, так как этот показатель является наиболее важным при оценке степени развития свободных эмбрионов и личинок.
Средний вес личинок и желточного мешка получали путем деления суммы весовых показателей на количество рыб в пробе [83].
По результатам осредненных данных вычисляли следующие показатели:
– запас желточного мешка в % от первоначального веса, определяли по формуле: Вес желточного мешка (Р ж.м.)(на отчетную дату) × 100 % / Вес жел-точного мешка (Р1 ж.м.) (первоначальный);
– резорбцию желточного мешка в мг за отчетный месяц – показывает ка-кое количество желтка израсходовано за отчетный месяц, определяли по формуле: Р ж.м. в предыдущий месяц – Р ж.м., полученный по анализу месячной резорбции желточного мешка в мг;
– доля желточного мешка от общего веса личинки (%) – вычисляли за весь период развития 2 раза – после выклева и на момент поднятия на плав. Этот пока-затель использовали для оценки влияния абиотических факторов на ход развития лососей и для накопления биостатистического материала.
Отклонения от оптимума считали в относительных величинах (Ϫ от сред-немесячных значений температуры на каждом этапе).
Обработку и анализ данных осуществляли в программах Microsoft Office Excel и R-Statistica. Для построения картосхем расположения рыбоводных заводов использованы космоснимки Google Earth.
Смотрите также
Бассейновый метод выращивания лососевых рыб
Особенности исскуственного воспроизводства тихоокеанских лососей