К обоснованию экологической емкости дальневосточных морей и субарктической пацифики для пастбищного выращивания тихоокеанских лососей
Мировой вылов водных биоресурсов в морях и океанах в последние 15 лет колеблется в пределах 92-100 млн т. Мировое производство аквакультуры в этот период возросло примерно с 20 до 54 млн т (Зиланов, 2009). Мощный прирост мировой аквакультуры, как известно, в первую очередь связан с развитием этой отрасли в Китае. Конечно, автоматически переносить опыт соседней страны на российский Дальний Восток и российское рыбное хозяйство нельзя.
Здесь другие условия и другие возможности. Тем не менее современные темпы развития мировой аквакультуры — по 2-3 млн т ежегодно — впечатляют, а кроме того, дают основание утверждать, что ситуацию в этой отрасли в России никак нельзя признать нормальной. Если производство аквакультуры в России в 1990 г. достигло 254 тыс. т, то в настоящее время оно находится на уровне 100-115 тыс. т в год (Зиланов, 2009).
Равным образом выводы о стагнации морского и океанического мирового рыболовства, во многом связанные с состоянием его сырьевой базы, также нельзя переносить на российский Дальний Восток. Здесь наша страна имеет мощную сырьевую базу для дальнейшего наращивания промыслового вылова рыбы и нерыбных объектов (Шунтов, 2008, 2009).
В морской аквакультуре рыб особые предпочтения отдаются лососям для товарного и пастбищного выращивания. В товарном выращивании лососей (семга и радужная форель) в первую очередь заслуживает внимания опыт Норвегии, где съем лососевой продукции достиг почти 1 млн т. Специалисты этой страны за короткий срок разработали биотехнику, создали маточный материал, корма и их производство, выростные хозяйства с соответствующей инфраструктурой (Зи-ланов, Лука, 2009). Во многом по "норвежскому сценарию" успешно развивается товарное выращивание лососей в Чили. Некоторый опыт выращивания товарной рыбы имеется и в России, главным образом в западных районах страны. В частности, производство товарной форели с 2002 по 2008 г. увеличилось с 5,2 до 16,5 тыс. т (Мамонтов, Захаров, 2009).
В странах Северной Пацифики (в том числе в России) уже изначально аквакультура лососей стала развиваться главным образом по пастбищному типу. Из большого количества видов промысловых рыб российского Дальнего Востока приоритетное значение для морского и океанического пастбищного выращивания как сейчас, так и на всю предвидимую перспективу имеют проходные тихоокеанские лососи рода Oncorhynchus. Они обладают высокой экологической пластичностью, имеют большие ареалы, легко осваивают нагульные океанические пространства, эффективно используя мощную кормовую базу (быстро превращая ее в ихтиомассу) обширной акватории субарктических вод Северной Паци-фики. Именно этот вид аквакультуры, в соответствии со спецификой малонаселенного (как в прошлом, так и сейчас) российского Дальнего Востока, появился здесь в зачаточной форме около ста лет назад. Аналогичным образом аквакуль-тура лососей развивалась и в других странах северотихоокеанского региона. Хотя следует заметить, что вполне перспективным представляется также пастбищное выращивание и других рыб, в частности осетровых.
В настоящее время в северотихоокеанском регионе функционирует около 700 лососевых заводов (ЛРЗ) — в основном в Японии и США, — выпускающих около 5 млрд экз. молоди лососей. Российское лососеводство имеет более скромные результаты (53 ЛРЗ, выпускающих до 700-900 млн экз. молоди), но имеет несомненную тенденцию к развитию.
Явное отставание России в искусственном воспроизводстве тихоокеанских лососей во многом связано с социально-экономическими причинами, недостаточностью кадрового и научно-технического потенциала, а также наличием на Дальнем Востоке собственного мощного естественного лососевого нерестового фонда, являющегося "бесплатным природным ресурсом", ежегодно воспроизводящим сотни тысяч тонн лососей.
В определенной степени темпы развития аквакультуры лососей в России сдерживались и сдерживаются спорами и разнобоем представлений о сути самой проблемы, включая альтернативные взгляды на формы этого вида рыбохозяй-ственной деятельности и даже на тему его целесообразности. Свою лепту здесь внесло и "зеленое движение", особенно его ортодоксальные представители, которые почти любое мероприятие по природопользованию начинают с трафаретных постулатов с акцентом на сохранение биоразнообразия. Так, настойчиво проводится мысль о вреде (и даже губительности для диких популяций) заводского разведения лососей для пастбищного выращивания и о проблематичности получения значительных результатов, в том числе прибыли, при таком виде хозяйствования (Лихатович, 2004; Запорожец, 2006; Бочарова, 2008; также "Позиция WWF по вопросам разведения" на сайте WWF России). В лучшем случае как альтернатива пастбищному выращиванию предлагается товарное выращивание лососей (Григорьев, Седова, 2008). Вообще возможность развития товарного выращивания лососей на Дальнем Востоке России отрицать нельзя, даже с учетом суровости омывающих его морей. Однако при реальной социально-экономической обстановке в регионе, ограниченном людском потенциале и большой затратности (в том числе материальной) подобных мероприятий рассчитывать на масштабные результаты этого вида аквакультуры, по крайней мере в ближайшие годы, не приходится.
В качестве аргументов противники пастбищного лососеводства используют реальные негативные факты и следствия, до сих пор имеющиеся в пастбищном лососеводстве (особенно российском): отрицательные генетические следствия, ухудшение санитарно-эпидемиологической ситуации, нередкие низкие коэффициенты возврата от выпускаемой с заводов молоди и т.д. Специальный однонаправленный подбор подобных фактов действительно может создать удручающее впечатление. Но при этом во многих случаях при анализе рассматриваемой проблемы уже изначально видна заданность позиции. Так, в недавней публикации американца Куаммена (2009) правильно пишется о вреде масштабного браконьерства на Камчатке и важности лососей для этого региона. Но одновременно настойчиво проводится мысль о том, что камчатских лососей становится все меньше (в реальности, как известно, в последние годы их численность росла). В то же время рекомендуется запасы не восстанавливать путем разведения. Для этого достаточно, по мнению Куаммена, развернуть сеть заповедников и заказников, а также оградить лососей от результатов хозяйственной деятельности и браконьерства (про браконьеров, конечно, верно).
Но в большой серии солидных публикаций, в том числе обобщающих, принадлежащих перу не любителей, а специалистов с большим опытом реальных исследований, рассмотрены все "узкие места" индустриального воспроизводства молоди лососей на ЛРЗ (Хованский, 2004; Сафроненков и др., 2005; Каев, Игнатьев, 2007; Тарасюк, Тарасюк, 2007; Каев, 2008; Марковцев, 2008, 2009; Хованская, 2008). В этих работах, а также в других публикациях последних лет (Коря-ковцев, 2000; Попова и др., 2005; Игнатьев, 2007; Марковцев, 2007а, б; Ксено-фонтов, Гольденберг, 2008; Куманцов, 2008; Хованская и др., 2008, 2009; Алексеев, 2009; Белянский, Хованский, 2009; Беспалова, Антипова, 2009) показано, что нередкие случаи (особенно в прошлом) низкой эффективности работы ЛРЗ на Дальнем Востоке связаны с целым рядом причин:
— Неудачный выбор мест для размещения некоторых ЛРЗ. Как и при естественном воспроизводстве, из-за физико-географической специфики ЛРЗ могут оказаться мало-, средне- и высокоэффективными. Поэтому строительству каждого завода должно предшествовать детальное комплексное обследование с соответствующими обоснованиями.
— Применение малоэффективных биотехнологий разведения или несоблюдение его режима на всех этапах эмбрионального и постэмбрионального развития и выращивания.
— Незначительные объемы выпуска искусственной молоди во всех российских регионах, кроме Сахалинской области. Особенно это касается лососей с продолжительным пресноводным периодом (сима, кижуч, чавыча, нерка — все без исключения очень ценные пищевые рыбы).
— Недостаточная адаптация (доводки) существующих прогрессивных биотехнологий к суровым климато-гидрологическим условиям северных районов Дальнего Востока.
Дополнительно кратко остановимся только на некоторых из обозначенных выше вопросов. Несомненно, заслуживают отдельных комментариев недавно опубликованные данные (Беспалова, Антипова, 2009) о преждевременности выводов некоторых экспертов о том, что по ряду причин не могут эффективно функционировать ЛРЗ в бассейне Амура вдали от Амурского лимана (в первую очередь имеется в виду Тепловский и Биджанский ЛРЗ, миграционный путь до которых от устья составляет до 1500 км). До Хабаровска (950 км от лимана), по некоторым оценкам, доходит только около 6 % заходящей в Амур осенней кеты. Часть ее распределяется для размножения в притоках нижнего и среднего течения Амура. Но на этом пути большой урон поголовью наносит браконьерский лов. Выше по течению от Хабаровска к российскому браконьерству добавляется и китайское. Таким образом, без знания конкретных объемов вылова на путях миграций рыбы, воспроизведенной указанными ЛРЗ, нельзя судить об эффективности их работы. Заметим при этом, что резервы для повышения эффективности далеко отстоящих от моря заводов имеются. Они связаны с реконструкцией упомянутых ЛРЗ (они функционируют с 1928 и 1933 гг.), а также возможностью использовать для подращивания молоди осенней кеты имеющиеся здесь благоприятные естественных водоемы (Беспалова, Антипова, 2009).
Что касается других ЛРЗ в бассейне Амура (всего их 5, кроме Тепловского и Биджанского, есть еще 3 в Хабаровском крае — Удинский, Гурский и Анюйс-кий), то эффективность их работы (особенно наиболее современного — Анюйс-кого) в последние годы значительно возросла. При этом возврат, определенный мечением, достиг 2 % (Белянский, Хованский, 2009). Заслуживает упоминания и весьма интересный факт создания на базе молоди кеты, выращенной на Анюй-ском заводе, промышленной популяции на оз. Тихом, в притоках которого естественные нерестилища отсутствовали (Марковцев, 2009).
Для оценки перспектив искусственного разведения большое значение имеют данные, полученные по выживаемости молоди кеты искусственного и природного происхождения в суровых условиях Магаданской области (Хованская и др., 2008). И заводская, и природная молодь обладают хорошей выживаемостью только при пропорциональном соотношении длины и массы тела, а также развитии внутренних органов. Погибает молодь (независимо от происхождения), у которой наращивание массы тела отстает от линейного роста. Молодь, выращенная на тепловодных ЛРЗ (Ямском, Тауйском), имеет высокую выживаемость в морской воде. А выращенная на холодноводных заводах (Ольская экспериментальная производственно-акклиматизационная база, Арманский) имеет слабую жизнеспособность из-за ее низкого физиологического статуса. Холодноводность или теп-ловодность ЛРЗ зависит от особенностей термики водоисточников: на холодно-водных температура воды в период смешанного и активного питания опускается до 0,4-1,0 °С, а тепловодных — варьирует от 3,2 до 4,4 °С.
Совершенствование биотехнологий воспроизводства лососей на российских заводах вполне обозначилось с конца 1990-х гг., и это реально отразилось на улучшении качества (морфологического и физиологического) выпускаемой молоди и, как следствие, — на увеличении выживаемости и возврата искусственно воспроизведенных рыб. Пастбищная аквакультура кеты в южной части Сахалина и на о. Итуруп обеспечивает 90 % вылова здесь этого вида (Каев, 2008). В целом же по Дальнему Востоку до 30-40 тыс. т (возможно, несколько меньше) вылова кеты и горбуши приходится на рыб ЛРЗ (Коряковцев, 2000; Каев, Игнатьев, 2007; Ксенофонтов, Гольденберг, 2008; Куманцов, 2008). Эти несомненно позитивные результаты приходятся главным образом на Сахалинскую область. В других районах российского Дальнего Востока производственный эффект пока незначителен из-за ограниченных масштабов разведения, а также в основном экспериментального характера воспроизводства.
Зарубежный опыт пастбищного разведения лососей, особенно в США и Японии, более значителен, а главное — имеет несопоставимо лучшие результаты. В общих промысловых уловах тихоокеанских лососей вклад искусственного воспроизводства составляет в Японии 90 % (200-240 тыс. т), на Аляске — около 31 % (97 тыс. т), в Республике Корея — 100 % (NPAFC, 2005; Херд, 2006; Марковцев, 2007б, 2008). Конечно, все это и собственный российский опыт позволяют надеяться на решаемость возникающих проблем в вопросах, не только направленных на улучшение существующих биотехнологий рыбоводных процессов, но и связанных с санитарно-эпидемиологическими условиями и генетическими последствиями селективного характера при подборе производителей, а также возникающих при взаимодействии диких и индустриальных стад. Во всех этих вопросах не все в настоящее время пока ясно и предсказуемо. Так, при обсуждении проблемы взаимного влияния лососей природного и искусственного происхождения эффект аквакультуры, как правило, постулируется с оговоркой "может быть негативным" (Einum, Fleming, 2001). Конечно, эта тема требует дополнительных исследований, при этом с учетом конкретных местных условий. Если же иметь в виду генетические аспекты проблемы, то некоторые общие принципы понятны и сейчас. Сошлемся только на рекомендательное заключение Ю.П. Алтухова (2001) о том, что в аквакультуре для поддержания маточных стад следует избегать как инбридинга, так и аутбридинга, поддерживая каждое стадо в отдельности как независимую целостную единицу. Кроме того, при производстве смолтов целесообразно отбирать родителей, характеризующихся средним уровнем гетерозиготности по совокупности аллозимных локусов. При воспроизводстве стад на рыбоводных заводах сбор искусственно оплодотворенной икры следует осуществлять на всем протяжении нерестового хода производителей в реку, избегая неравномерного изъятия половых продуктов или предпочтения крупных рыб мелким (и наоборот).
Вряд ли правы противники масштабной аквакультуры и в том, что она вообще не может восполнить потери от браконьерства и других форм разрушающего антропогенного воздействия на природу. Конечно, в настоящее время законопослушность и экологическая грамотность россиян в целом находятся на низком уровне, но нет оснований говорить о необратимости этих явлений. Природоохранные мотивы стали обязательным атрибутом всех сколько-нибудь значительных проектов. Если иметь в виду лососевое хозяйство, то в настоящее время серьезно и квалифицированно исследуются и браконьерство, и проблемы снижения антропогенного воздействия как на лососей, так и на среду их обитания. Разработки последних лет в этих направлениях заканчиваются конкретными рекомендациями (Дронова, Спиридонов, 2008; Региональная концепция ..., 2008; Леман, Лошкарева, 2009).
Важно подчеркнуть, что при обсуждении планов и перспектив пастбищного лососеводства специалисты, работающие в этой области, как правило, рассматривают искусственное разведение лососей на ЛРЗ не как альтернативу или замену естественного воспроизводства, а как дополнительный элемент в поддержании популяций и в целом запасов этих рыб. В первую очередь при этом следует иметь в виду районы, где эффективность естественного воспроизводства лососей очень низка из-за сильного сокращения поголовья производителей или разрушения хозяйственной деятельностью речных систем (нерестового фонда), а также районы и водотоки с неустойчивым режимом, особенно в суровых северных районах.
На рубеже 20-го и 21-го столетий в связи с развитием сети ЛРЗ в очередной раз усилилось внимание к теме экологической (приемной) емкости дальневосточных морей и субарктической Пацифики для лососей. Напомним, что в 1970-е гг., когда в Советском Союзе разрабатывалась крупномасштабная КЦП "Лосось", бытовали представления о неограниченности в океане запасов планктона, т.е. кормовой базы для лососей. Допускалось, что при рациональном промысле и значительном расширении масштабов пастбищной аквакультуры лососей их ежегодный вылов может составить 500 тыс. т (Коновалов, 1985, 1986). В рабочем порядке постулировался даже уровень в 800 тыс. т. О масштабе этих намерений можно судить по тому, что в 1970-е гг. советский вылов лососей составлял всего 43 тыс. т и только в конце 1970-х гг. поднялся до 130-140 тыс. т.
Не исключено, что планы значительного расширения российского пастбищного лососеводства в определенной мере стимулировали появление в 1990-е гг. большого количества публикаций (сначала в Японии и США, а затем и в России) о жестком лимитировании лососей пищей, обострении пищевой конкуренции и даже о переполнении северотихоокеанской пелагиали этими рыбами со всеми вытекающими из этого последствиями, даже о перестройке трофических цепей в океанской пелагиали и деградации популяций (Ishida et al., 1993; Bigler et al., 1996; Kaeriyama, 1996; Nagasawa, 1999; Гриценко и др., 2000; Кловач, 2003). Вообще же в России тему напряженных пищевых отношений в "лососевых сообществах" в начале второй половины 20-го столетия стала "нагнетать" камчатская научная школа И.Б. Бирмана (1985).
Однако такая драматизация событий не обосновывалась достоверными фактами, в качестве аргументов использовались только некоторые данные о снижении временами темпа роста у части стад лососей и дряблость мышц кеты из дрифтерных уловов. В то же время комплексные материалы многочисленных экспедиций ТИНРО-центра свидетельствовали о благополучной экологической обстановке в дальневосточных морях и Северной Пацифике для лососей и многих других промысловых рыб (Шунтов и др., 1993, 2007; Шунтов, 2001, 2008; Темных, 2004; Темных и др., 2004; Шунтов, Темных, 2004, 2008а; Кузнецова, 2005; Чучукало, 2006). Эти выводы подтверждались и ростом численности лососей. Вопреки этому некоторые российские специалисты (Гриценко и др., 2001), ранее доказывавшие идею о перенаселенности субарктической пелагиали лососями, вскоре представили очередную версию, согласно которой в связи с похолоданием и предыдущей повышенной смертностью для лососей в 2000 г. наступила очередная эпоха, когда напряженность пищевых отношений уменьшилась, а обеспеченность пищей увеличилась, что явилось следствием снижения их поголовья. Но, как хорошо известно, в 2000-е гг. численность азиатских лососей продолжала увеличиваться, и в 2009 г. их подходы к российским берегам находились на историческом максимуме, а официальный вылов составил 542 тыс. т (вместе с японским дрифтерным ловом в водах России почти 550 тыс. т). При этом размерные показатели лососей многих азиатских и американских стад в 2000-е гг. не уменьшились, а у некоторых даже увеличились. В очередной раз без каких-либо конкретных фактов и обоснований была предложена новая версия — об увеличении в настоящее время экологической емкости пелагиали для лососей.
Почти любые версии имеют право на существование, но только в предварительном плане. Для доказательств же нужны факты, тем более для выводов по такой сложной проблеме, как экологическая емкость. В данном случае необходимы конкретные материалы, имеющие прямое отношение к работе фактора плотности. Более конкретно разговор в первую очередь должен идти о лимитировании (контроле) численности лососей "снизу", т.е. через обеспеченность пищей (состояние и объем кормовой базы, масштаб ее потребления в целом и конкретными группами нектона в частности, степень ее выедания и напряженность внутри-и межвидовой конкуренции). По всем этим вопросам в последние 25 лет в ТИН-РО-центре накоплены масштабные ряды количественных наблюдений, которые в настоящей серии сообщений используются для обоснования экологической (приемной) емкости дальневосточных морей и субарктической Пацифики для пастбищного выращивания тихоокеанских лососей. Эта тема будет последовательно раскрываться в 4 сообщениях, в которых предполагается обобщить наши представления о нагульных акваториях лососей, запасах в них пищи, рационах, избирательности питания, обеспеченности пищей этих рыб и их роли в потреблении кормовой базы нектона.
Цель настоящей работы — обобщение данных о нагульных акваториях тихоокеанских лососей.
Материалы и методы
В этом разделе каждого из 4 сообщений статьи будут приводиться методические сведения, относящиеся только к теме конкретного сообщения, в данном случае к методике сбора и обработки данных по распространению, количественному распределению, численности и районам основных концентраций всех видов тихоокеанских лососей в течение годичного цикла.
Данное сообщение основано главным образом на результатах траловых съемок нектона, включая лососей, более 100 экспедиций ТИНРО-центра, ежегодно выполнявшихся с начала 1980-х гг. на всей акватории дальневосточной российской экономической зоны. Кроме того, несколько экспедиций было осуществлено в более восточные районы — центральную часть Северной Пацифики и восточную часть Берингова моря (в том числе на японских и американских судах). В общей сложности было выполнено более 25 тыс. стандартных часовых пелагических тралений. Охваченная при этом более или менее регулярными съемками акватория российской зоны и сопредельных вод составила около 6 млн км2.
Траловые съемки, сопровождаемые гидрологическими и планктонными станциями, выполнялись канатными тралами (РТ 108/528 м, РТ 118/620 м, РТ 80/396 м). При облове лососей обычно выдерживался режим траления с распорным щитком на поверхности при скорости около 4,5 уз с вытравлением не менее 250-300 м ваеров. Важным методическим моментом при расчетах численности (в экземплярах на квадратный километр) и биомассы (в килограммах на квадратный километр) лососей и других представителей нектона на квадратный километр было
применение дифференцированных коэффициентов уловистости: от 0,01 (личинки, мальки) до 1,0. Для молоди лососей до 30 см применялся коэффициент 0,4, а для рыб крупнее 30 см — 0,3. В 1980-1990-е гг. параметры вертикального и горизонтального раскрытия трала определялись расчетным путем с учетом горизонта траления, длины ваеров и скорости судна, а в 2000-е гг. — также при помощи приборов. Методика расчетов рабочих параметров тралов, численности и биомассы рыб подробно изложена во многих публикациях авторов настоящей статьи, в том числе в 4 томах атласов количественного распределения нектона (Атлас ..., 2003-2006). Как и в этих атласах, численность и биомасса лососей на схемах настоящей статьи представляются по одноградусным трапециям.
Результаты и их обсуждение
Ареалы тихоокеанских лососей
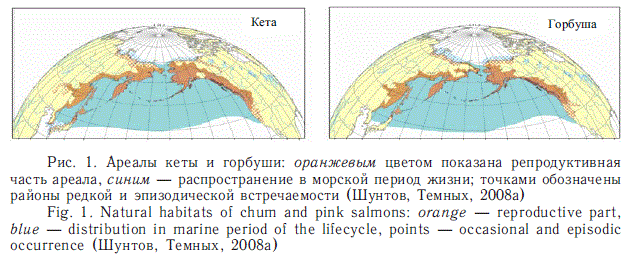
Тихоокеанские лососи рода ОпсоЛуп^^ являются широкобореальными видами. Их ареалы (как пресноводные, так и океанические) почти не выходят за пределы субарктического пояса, а на юге ограничиваются зоной Субарктического фронта. На юге граница распространения лососей опускается лишь незначительно южнее 40о с.ш. в северо-западной части океана (но на несколько градусов дальше в Японском море), а на севере в летнее время часть их проникает севернее Берингова пролива. На рис. 1 показаны ареалы двух наиболее массовых видов — кеты и горбуши.
Потенциальная область морского и океанического распространения тихоокеанских лососей занимает площадь около 15 млн км2 (из них на Берингово, Охотское, Японское и Чукотское моря приходится около 5 млн км2). Но в конкретные сезоны они встречаются примерно на половине площади этой акватории. Зимой их нет или они имеют низкую численность в северных (особенно северозападных) районах, а летом — в южных.
За исключением симы O. masou, которая так и не стала океаническим видом, остальные виды рода Oncorhynchus широко освоили океанскую субарктическую пелагиаль. Наиболее обширные ареалы (при этом похожие) имеют кета O. keta и горбуша O. gorbuscha. Нерка O. nerka, кижуч O. kisutch и чавыча O. tschawytscha, в отличие от них, мало проникают в Арктику и меньше представлены в западной части обширного ареала, в частности нерка ни разу не была встречена в Японском море, чавыча — только эпизодически, а кижуч — очень редко.
Важно отметить, что в связи с некоторым потеплением в последнюю четверть века усилилось воспроизводство части стад лососей в высоких широтах, а в южно-бореальных районах, за некоторыми исключениями, напротив, уменьшилось.
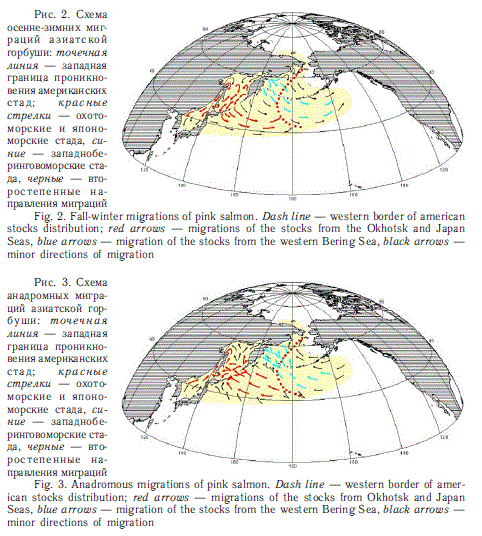
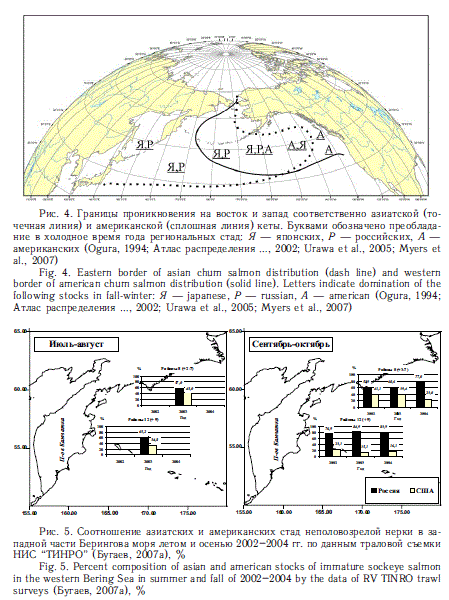
Для оценки условий морского нагула региональных стад лососей необходимы конкретные представления об областях их распространения в морях и океане. В общем плане, если не считать симу с ее локальным приазиатским распространением, при сравнении азиатских и американских лососей вполне прослеживается следующее правило: имеющие более высокую численность азиатские виды (кета и горбуша) на восток проникают дальше, чем американские на запад. Это хорошо видно на рис. 2-4.
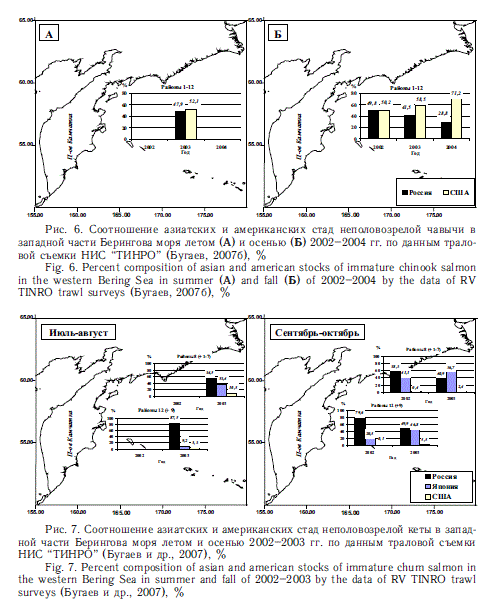
С другой стороны, имеющие более высокую численность на американском материке нерка, кижуч и чавыча дальше проникают на запад, чем азиатские представители этих видов на восток. Особенно отчетливо это проявляется в районе Берингова моря (рис. 5, 6). Американская кета, которая в Беринговом море почти достигает азиатских берегов, встречается здесь в небольшом количестве (рис. 7). Данные факты необходимо учитывать при оценках потребления пищи региональными стадами.
Освоение посткатадромной молодью лососей открытых вод и основные районы ее осеннего нагула
Новые весьма объемные данные многочисленных комплексных учетных экспедиций ТИНРО-центра в 1980-2000-е гг. принципиально изменили представления о количественном распределении посткатадромной молоди лососей на разных этапах ее нагула. Уникальная информационная база, сформированная с применением ГИС-технологий, уже использовалась при подготовке фундаментальных серий каталогов и атласов нектона (Атлас ..., 2003-2006; Нектон ..., 2003-2006), в которых количественное распределение (атласы) и состав (каталоги) нектона даны отдельно по трем дальневосточным морям и СЗТО. В настоящей работе распределение молоди лососей дается в другом формате (Шунтов и др., 2006, 2007), а именно: в виде интегральных схем для всей акватории дальневосточной экономической зоны России с сопредельными нейтральными водами СЗТО. При этом исходная база данных дополнена новой информацией за последние годы.
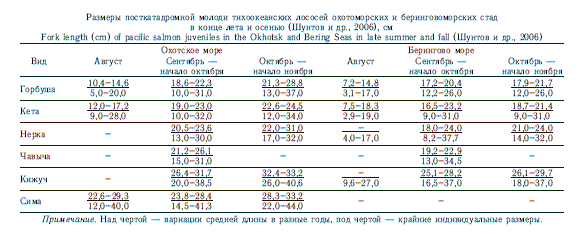
В российских водах основное время нагула посткатадромной молоди лососей за пределами шельфа приходится на август — первую половину ноября. В этот период ее размеры за небольшими исключениями не выходят за пределы 30 см (см. таблицу).
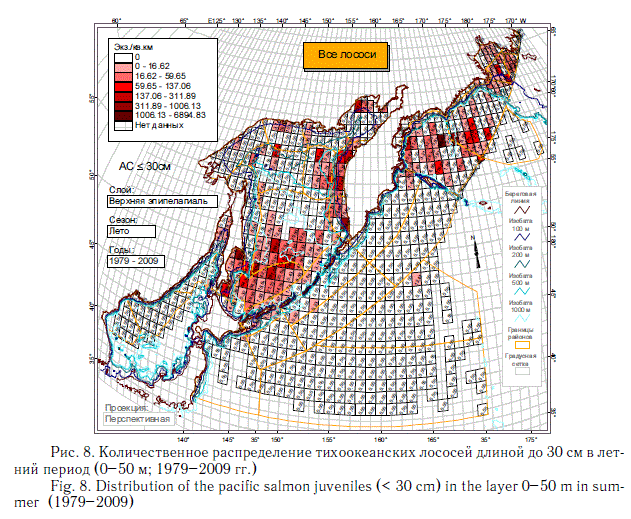
Летом (со второй половины июля до середины сентября) четко обозначаются три района повышенных концентраций молоди лососей: юг Охотского моря; воды, сопредельные с западной Камчаткой; и Командорская котловина Берингова моря (рис. 8). На юге Охотского моря концентрации формируют главным образом восточ-носахалинские, южнокурильские и японские (индустриальные) лососи, в прикамчатских водах Охотского моря — в основном западнокамчатские, в Командорской котловине — рыбы карагинско-олюторского района и р. Камчатка.
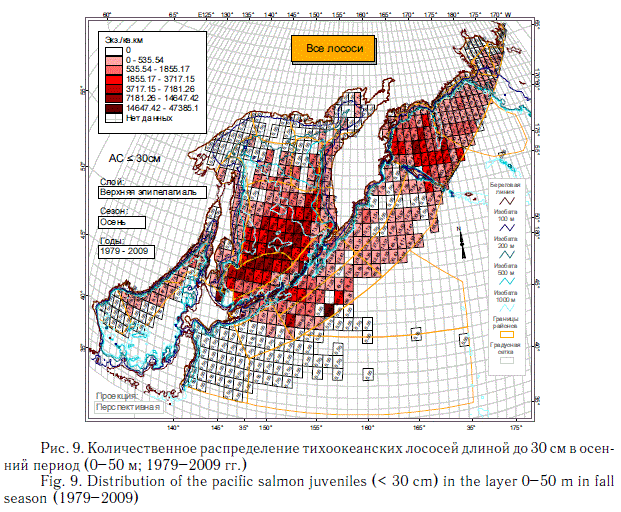
В целом численность по-сткатадромной молоди летом в открытых водах еще не очень большая. Но уже в первой половине осени значительная ее часть покидает воды внутреннего шельфа, поэтому в открытом море ее количество возрастает на порядок (рис. 9). В это время она встречается, по существу, на всей акватории российской экономической зоны. В Охотском море формируется обширный район повышенных концентраций, включающий большую часть глубоководной котловины. В конце осени отсюда начинается выход молоди в океан, наиболее интенсивный через проливы Фриза, Буссоль, Дианы и Надежды, через которые мигрируют самые массовые лососи — горбуша и кета. В связи с этим и в прикурильс-ких водах океана наиболее плотные концентрации молоди бывают в районе именно этих проливов. Через северные проливы основной массой мигрируют менее многочисленные виды — нерка, кижуч, чавыча.
В Беринговом море осенью основным районом концентраций посткатадромной молоди остается Командорская котловина, куда перераспределяется и значительная часть молоди р. Камчатка. Между районами основных скоплений охотоморских и беринговоморских лососей осенью располагается обширная восточнокамчатская зона с пониженной плотностью их концентраций. Это свидетельствует о преимущественно юго-восточном направлении осенних миграций молоди в районы зимнего обитания как из прикурильских вод, так и из Берингова моря.
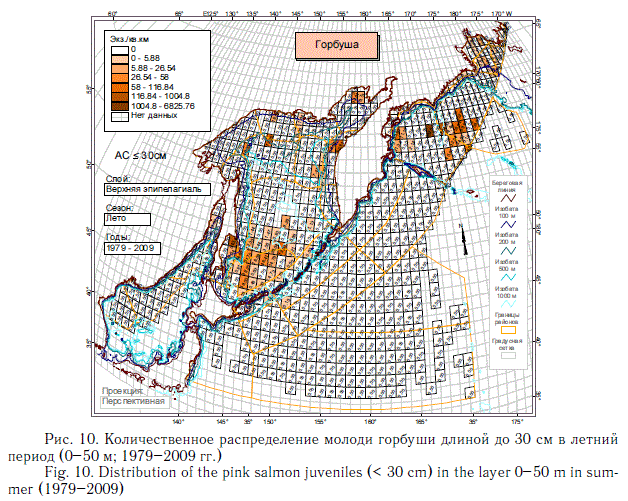
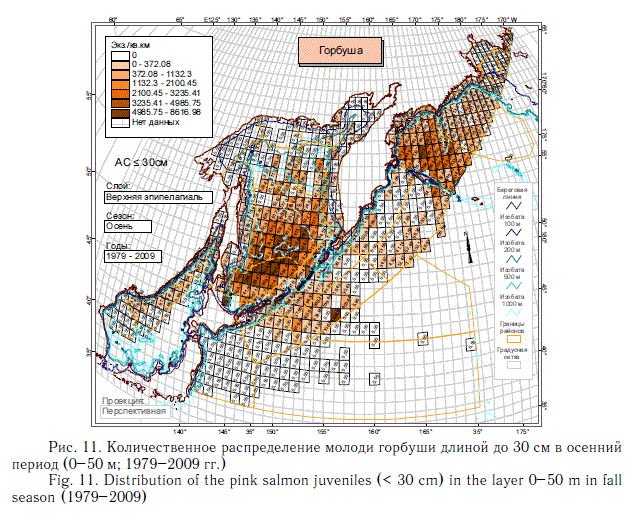
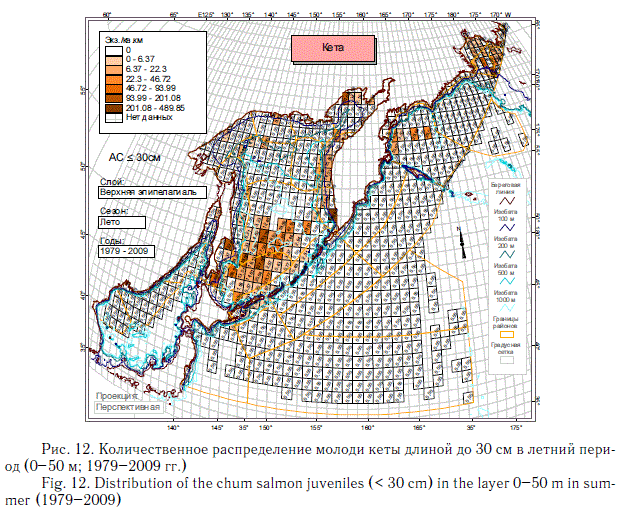
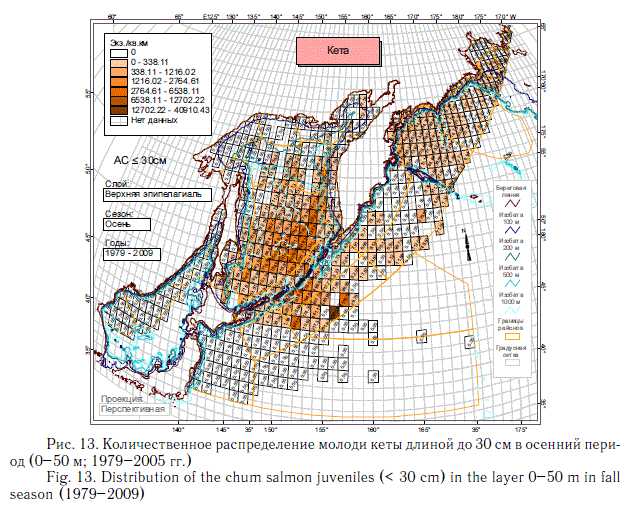
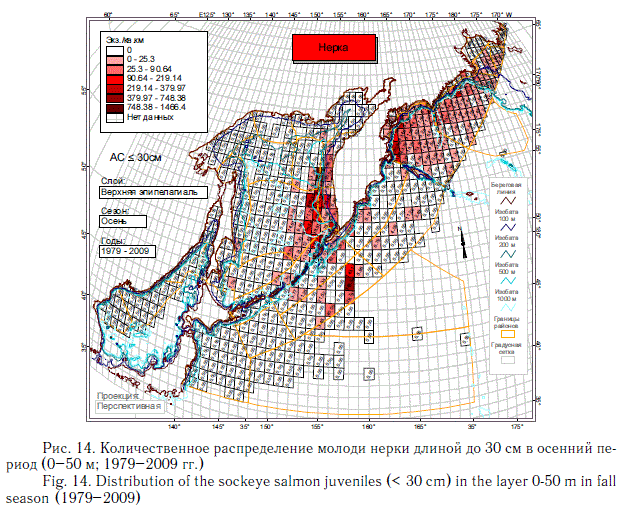
На описанное выше количественное распределение суммарной численности посткатадромной молоди лососей основной отпечаток накладывают наиболее массовые виды — горбуша (рис. 10, 11) и кета (рис. 12, 13). Распространение молоди других видов тихоокеанских лососей заметно отличается от распространения горбуши и кеты. Азиатская нерка в основном воспроизводится в Камчатском регионе. Восточнокамчатская нерка в первый морской летне-осенний период концентрируется преимущественно в Беринговом море, а западнокамчатская — в восточной части Охотского моря и у северных Курильских островов (рис. 14).
Азиатский кижуч также воспроизводится в основном на Камчатке. Районы летне-осенних концентраций посткатадромной молоди его камчатских стад мало отличаются от районов распределения нерки. Но у кижуча и летом, и осенью выделяется еще один район концентраций в открытом море — южная часть Охотского моря, где, несомненно, преобладают рыбы сахалинского происхождения (Шунтов, Темных, 2008а).
Также преимущественно камчатский вид — азиатская чавыча, которая по распространению мало отличается от нерки и кижуча (Шунтов, Темных, 2008а). Следует подчеркнуть, что значительные концентрации чавычи, нерки и кижуча осенью в Командорской котловине и сравнительно невысокая их плотность в во-сточнокамчатских водах южнее Командорских островов могут быть объяснены только миграцией при летне-осеннем распространении молоди этих рыб из р. Камчатка в Берингово море вдоль шельфа через Камчатский пролив.
Наиболее специфично распространение симы. Посткатадромная молодь япономорских стад этого вида на нагул в основном заходит в воды южной котловины Охотского моря. Здесь она перемешивается с особями из рек побережий южной части Охотского моря. Летом выделяется еще один район обитания симы — в северо-восточной части моря, где концентрируется молодь из рек западной Камчатки. Осенью эта молодь также смещается в воды южной котловины моря (Шунтов, Темных, 2008а).
Описанные особенности количественного распределения посткатадромной молоди тихоокеанских лососей наиболее представительны благодаря большому объему новой информации, на основании которой они выявлены. Они позволяют делать многие выводы, в том числе о характере использования группой в целом или конкретными видами лососей нагульных акваторий субарктической зоны. За исключением горбуши и частично симы, остальные виды не используют или почти не используют Японское море, в котором много кальмаров, мелких рыб и умеренно высокие биомассы макропланктона. В Охотском море, отличающемся наиболее значительными концентрациями макропланктона, лососи в среднем немногочисленны в северной и северо-западной частях моря. Большая часть нагульной молоди горбуши, кеты и симы концентрируется в водах южной и центральной котловин моря. Посткатадромная молодь западнокамчатских стад нерки, чавычи и кижуча далеко за пределы шельфа на запад не распространяется, а мигрирует к северокурильским проливам, а затем в океан. Существенно, что молодь этих видов, а также кеты начиная со второго морского года мало использует Охотское море для нагула. В дальнейшем она заполняет Берингово море и сопредельные с ним воды Северной Пацифики. Описанное распределение невозможно объяснить особенностями современных океанологических условий. В описанной дифференциации распределения уже в первый морской год, скорее всего, проявляется исторически сложившееся разделение нагульных акваторий.
Следует отметить еще одну интересную особенность освоения открытых вод молодью лососей. Во второй половине лета она активно проникает в воды глубоководных котловин Охотского и Берингова морей, но совершенно очевидно избегает открытых вод океана, и за пределами внутреннего шельфа ее мало или почти нет на всем протяжении от Хоккайдо до Командорских островов (см. рис. 8). Массовая кета с восточного побережья Японии (как и из других районов этой страны) сначала скапливается в Охотском море. Здесь же до осени держится большая часть молоди с Курильских островов, а молодь крупной р. Камчатка мигрирует в Командорскую котловину Берингова моря. Из этого следует вывод, что в рассматриваемый период молодь всех видов лососей еще не становится океанической жизненной формой. Кстати, и у океанского побережья США и Канады летом молодь также не уходит в открытые воды, т.е. за пределы шельфа, а мигрирует вдоль побережий в зал. Аляска. Но в восточной части Берингова моря она, как и в Охотском море, и в западной части Берингова моря, еще летом активно мигрирует в открытые воды. Осенью ситуация в этом смысле в океане изменяется кардинально: молодь начинает осваивать открытые океанические акватории (Beamish et al., 2003; Brodeur et al., 2003).
Представленное на рис. 8-14 количественное распределение посткатадром-ной молоди лососей является весьма характерным и подтверждается ежегодными стандартными осенними съемками ТИНРО-центра, имеющими в настоящее время полноценный мониторинговый характер. Разные годы в этом смысле различаются показателями общей численности лососей, соотношением их видов, а также соотношением лососей в целом и остального нектона. Так, в Охотском море биомасса посткатадромной молоди обычно оценивалась от 104 до 444 тыс. т, а в Беринговом море — от 8 до 59 тыс. т (Шунтов, Темных, 2008а).
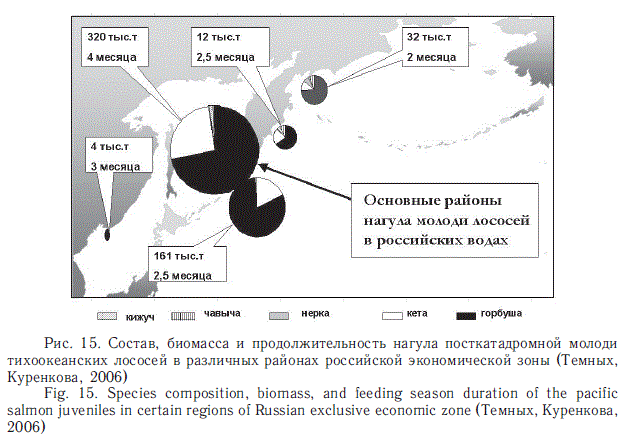
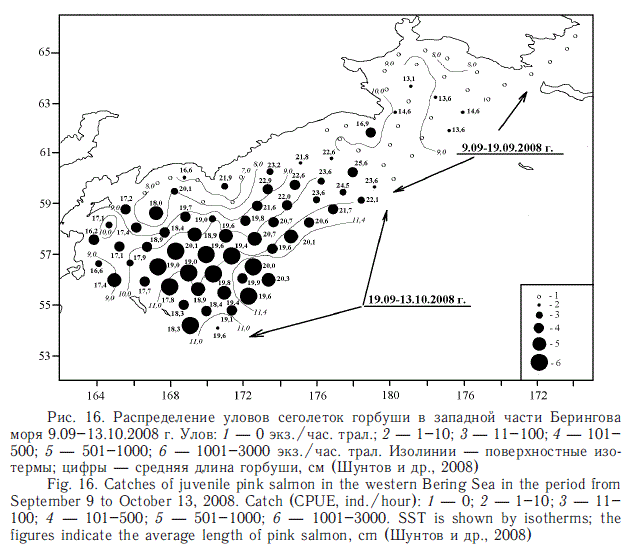
В генерализованном виде о значении различных районов российских вод для летне-осеннего нагула посткатадромной молоди лососей дает представление рис. 15. По масштабности нагула со всей очевидностью выделяются южная часть Охотского моря и южная часть океанических прикурильских вод. Основу биомассы и численности здесь слагают сеголетки горбуши всего охотоморского бассейна и кеты российских и индустриальных японских стад. Берингово море в данном случае не выделяется из-за в среднем общей пониженной численности посткатадромной молоди, хотя для молоди российских стад нерки, кижуча и чавычи оно имеет первостепенное значение. Однако в отдельные годы картина и в этом районе бывает иной. В частности, уникальная ситуация наблюдалась в западной части Берингова моря осенью 2008 г. Впервые за всю историю здесь было учтено около 1,3 млрд сеголеток горбуши общей массой почти 100 тыс. т (рис. 16). В прежние годы обычно учитывалось не более 100-200 млн экз. и только один раз в 2006 г. — 644 млн экз.
Таким образом, сама природа предоставила возможность оценить экологические последствия появления в данном районе чрезвычайно урожайного поколения. Мы еще вернемся к судьбе этого поколения. Здесь же только отметим, что очень высокая численность горбуши в сентябре — начале октября 2008 г. в юго-западной части Берингова моря оказалась достаточной, чтобы вызвать работу фактора плотности. Сеголетки были на 1,0-1,5 см меньше среднемноголет-них, а главное — они на две недели раньше начали рассредоточиваться и уходить в приалеутские воды (в районы зимнего обитания), хотя температура воды в юго-западной части моря была еще довольно высокой — до 11,5 оС.
Районы нагула молоди старше одного морского года и взрослых лососей в российской экономической зоне
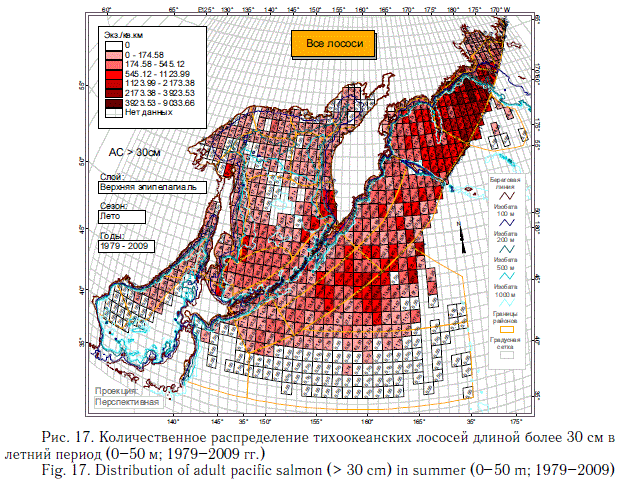
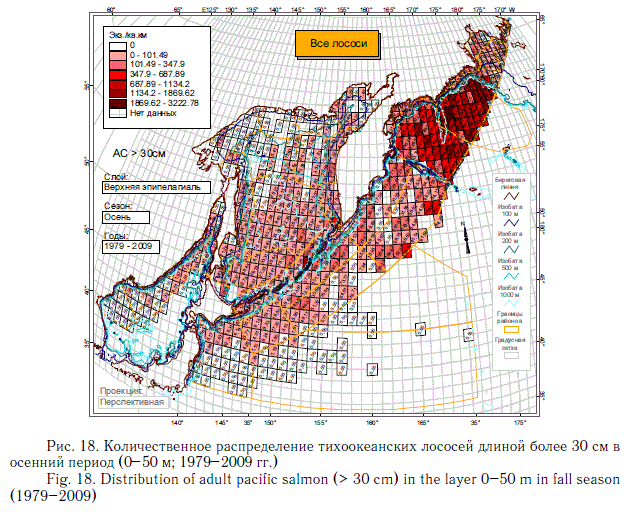
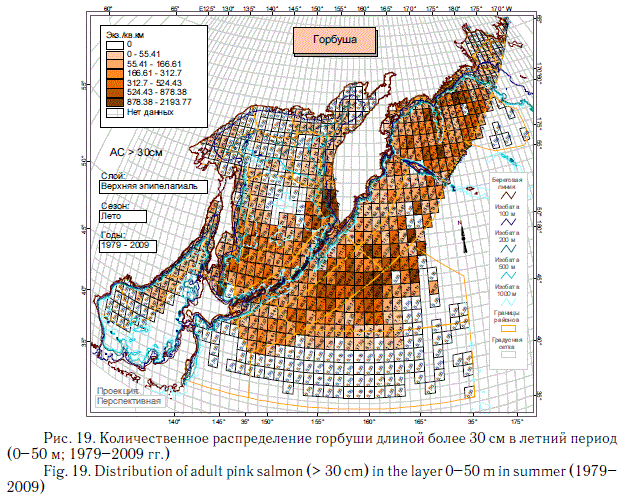
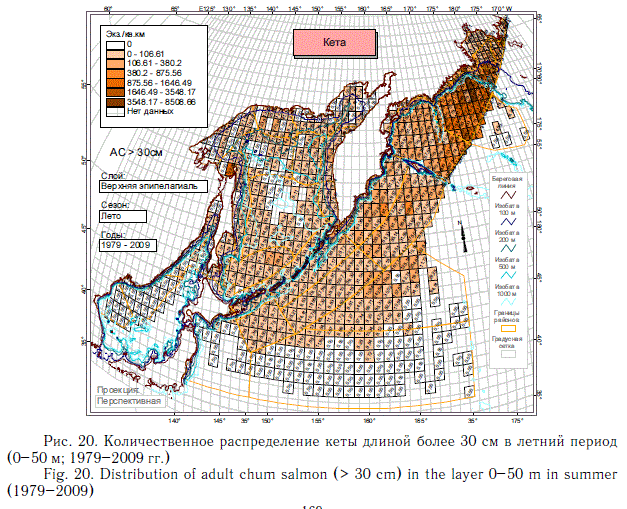
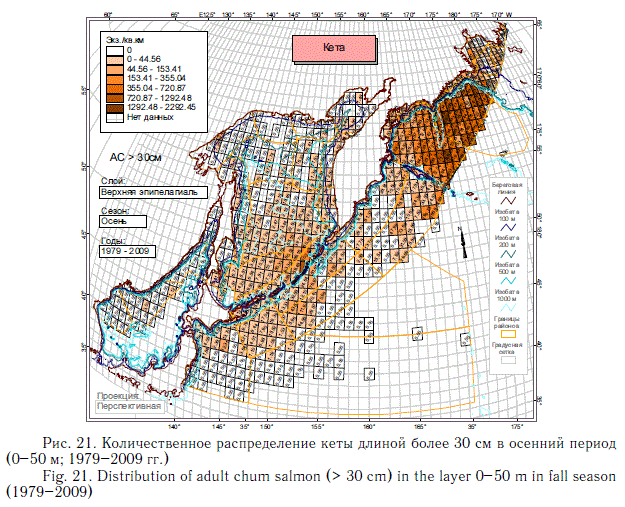
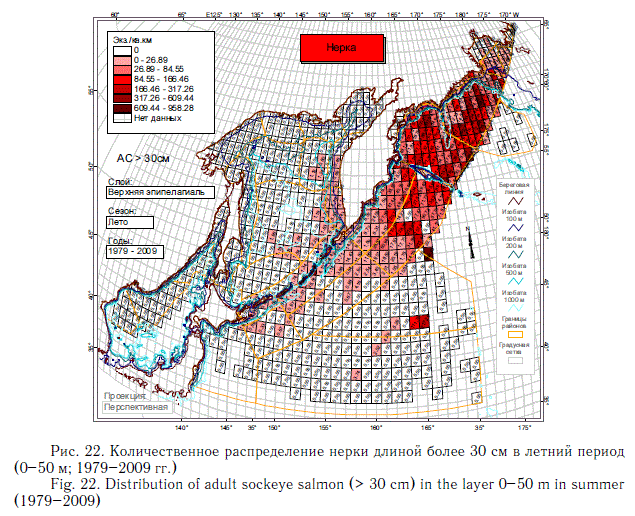
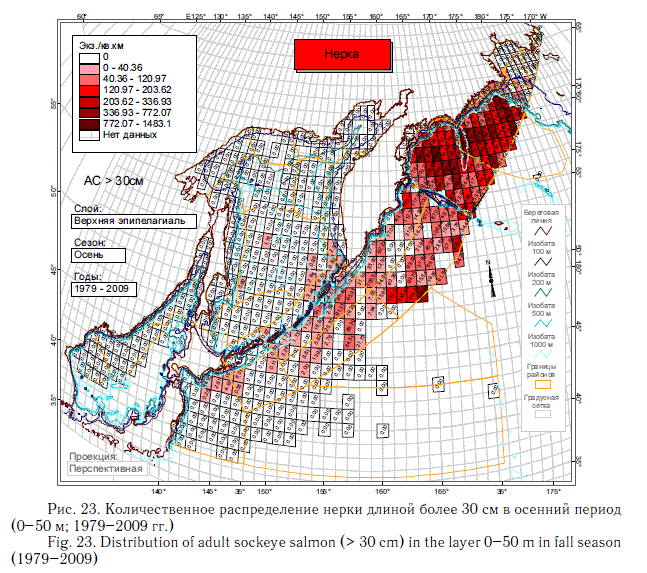
В этом разделе рассматривается количественное распределение лососей длиннее 30 см в летний и осенний периоды примерно в течение 6 мес (июнь-ноябрь), когда значительная часть поголовья российских стад находится в пределах экономической зоны РФ. Как и в случае с посткатадромной молодью, данные многочисленных экспедиций ТИНРО-центра по этим размерно-возрастным группам были обобщены в каталогах и атласах (Атлас ..., 2003-2006; Нектон ..., 2003-2006). В масштабе карт распределения посткатадромной молоди (см. рис. 8-14) они были приведены в специальном обобщении (Шунтов и др., 2007). В настоящей статье они дополнены данными экспедиций последних лет (как и в случае с посткатадромной молодью, приведены схемы только самых массовых видов). На рис. 17-23 хорошо видно, что по сравнению с посткатадромной молодью крупные неполовозрелые особи и производители имеют более обширные области с повышенными концентрациями. Для горбуши в порядке убывания это вся глубоководная часть Охотского моря и прикурильские воды океана, а также глубоководная часть Берингова моря (см. рис. 19). Для кеты и летом, и осенью — в первую очередь Берингово море, затем прикамчатские и прикурильские воды океана, затем Охотское море (рис. 20, 21). Для нерки — глубоководная часть Берингова моря, затем прикамчатские воды СЗТО (рис. 22, 23). Для кижуча — прикамчатские и прикурильские воды со стороны Охотского моря и Тихого океана (Шунтов, Темных, 2008а). Для чавычи — западная часть Берингова моря, восточная часть Охотского моря и прикурильские воды СЗТО (Шунтов, Темных, 2008а). Для симы — южная часть Охотского моря и Татарский пролив в Японском море (Шунтов, Темных, 2008а).
Наиболее значительные концентрации лососей крупнее 30 см наблюдаются в летний период (см. рис. 17-23). В это время через российские воды проходят анадромные потоки половозрелых рыб, которые на пути к нерестовым рекам донагуливаются.
Крупная неполовозрелая молодь, совершая миграции вслед за производителями, нагуливается как в течение лета, так и осенью. Осенью, когда основная масса производителей находится или в пресных водоемах, или в водах внутреннего шельфа, в открытых водах количество нагуливающихся рыб заметно снижается (см. рис. 18), особенно у короткоцикловой горбуши. В этом контексте исключение представляет только сима с ее коротким морским периодом жизни и быстрым ростом в первые месяцы морской жизни.
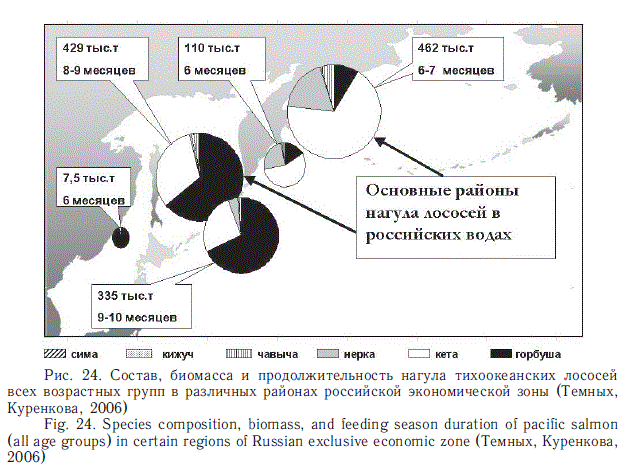
В связи с тем что в западной части Берингова моря кроме стад лососей, размножающихся в его бассейне, нагуливаются представители многих популяций из других азиатских группировок (особенно японской искусственной кеты), а также американских (нерка, чавыча, кижуч, частично кета), этот район при ранжировании по значимости для нагула превосходит даже Охотское море и тем более другие районы. Далее они могут быть перечислены в следующем порядке: глубоководная часть Охотского моря, прикурильские воды СЗТО, прикамчатские воды СЗТО, Японское море и Анадырский залив (рис. 24).
Учитывая важность для мониторинга численности лососей и условий их нагула в летние и осенние сезоны, в перечисленных выше трех районах наиболее значительных их концентраций по существу ежегодно в 2000-е гг. ТИНРО-центр проводит комплексные экспедиции. При этом осенними учетами охватываются южная часть Охотского моря, где длительное время нагуливаются сеголетки горбуши и кеты, и западная часть Берингова моря, где кроме местной посткатадромной молоди (горбуша, кета, нерка, чавыча, кижуч) нагуливаются крупные неполовозрелые особи (в возрасте одного морского года и старше) из многих стад азиатского и американского материков (в том числе американская нерка и чавыча, а также многочисленная японская кета).
О масштабах концентраций лососей осенью в западной части Берингова моря свидетельствуют следующие оценки: 2002 г. — 564 тыс. т, 2003 г. — 400, 2004 г. — 289, 2006 г. — 607, 2007 г. — 194, 2008 г. — 501, 2009 г. — 254 тыс. т (Шунтов, Темных, 20086; с дополнениями).
В летний период аналогичными наблюдениями охватываются прикурильс-кие океанические воды, через которые проходят миграции лососей в Охотское море и к Японии, а также западная часть Берингова моря, куда выходят из приалеутских вод и центральной части Берингова моря российские лососи и все та же японская кета.
В западной части Берингова моря в июне-июле были получены следующие оценки биомасс лососей: 2003 г. — 843 тыс. т, 2005 г. — 473, 2007 г. — 374, 2009 г. — 687 тыс. т, а в прикурильских водах: 2004 г. — 570 тыс. т, 2006 г. — 449, 2007 г. — 603, 2008 г. — 414, 2009 г. — 892 тыс. т (Шунтов и др., 2007; Шунтов, Темных, 20086; с дополнениями).
Как отмечалось выше, в летних миграционных потоках на беринговоморс-ком направлении в сопоставимых количествах представлены и производители, и крупная молодь лососей. Первые в это время интенсивно донагуливаются, а для нагула вторых данный период является одним из важнейших в годичном цикле.
По данному разделу в общем плане подчеркнем некоторые моменты.
1. В основных районах концентраций лососей во время осенних учетов в 2000-е гг. учитывалось в среднем около 700 тыс. т лососей, а во время летних — около 1180 тыс. т (в июне-июле 2009 г. было учтено почти 1700 тыс. т). В обоих случаях некоторое количество особей находилось за пределами этих районов. При этом во время осенних учетов часть их уже отмечалась восточнее в открытых водах, а в начале лета еще не все мигранты вошли в районы мониторинга. Таким образом, можно обоснованно допустить, что через российскую экономическую зону в течение года проходит не менее 2 млн т лососей всех видов (но, по-видимому, не более 2,5 млн т) с абсолютным преобладанием горбуши и кеты. Сами по себе это солидные цифры, однако если их сопоставить с количеством всего нектона в эпипелагиали этих же районов, то это количество (биомасса) окажется не очень заметным в общей биомассе нектона. В 1980-е гг. общая биомасса рыб и кальмаров оценивалась в 53 млн т, а на рубеже 1990-х — 2000-х гг. — около 32 млн т с тенденцией к росту (Шунтов, 2009). Таким образом, в эпипелагиали на долю лососей приходится 4-6 %, а с учетом нектона мезопелагиали — 2-3 %.
2. Основной нагул лососей, когда они наращивают большую часть своей ихтио-массы, протекает за пределами шельфа, где на большей части акватории субарктических вод численность эпипелагических рыб значительно уменьшается (минтай, сельдь, мойва, песчанка и др.). В верхней эпипелагиали в районах основного нагула доля лососей в общей биомассе нектона несоизмеримо выше: осенью в Охотском море — в среднем 66 %, в Беринговом море — 50, летом в СЗТО — 30, в Беринговом море — 56 % (Нектон ..., 2003-2006). Таким образом, можно уверенно заключить, что все тихоокеанские лососи на соответствующем эволюционном этапе освоения морской среды сумели в значительной степени пространственно и биотопичес-ки разойтись с другими эпипелагическими планктоноядными рыбами. В таком же контексте, на наш взгляд, можно рассматривать и время их пребывания в открытых водах южной части субарктической зоны. Лососи сюда откочевывают поздно осенью и в начале зимы, когда в этих районах в основном уже закончили нагул и ушли на юг субтропические пелагические рыбы (сардина, анчоус, скумбрия, тунцы). Равным образом в начале лета лососи уходят из южнобореальных районов в северобо-реальные, когда южные виды основной массой еще не подошли сюда на нагул.
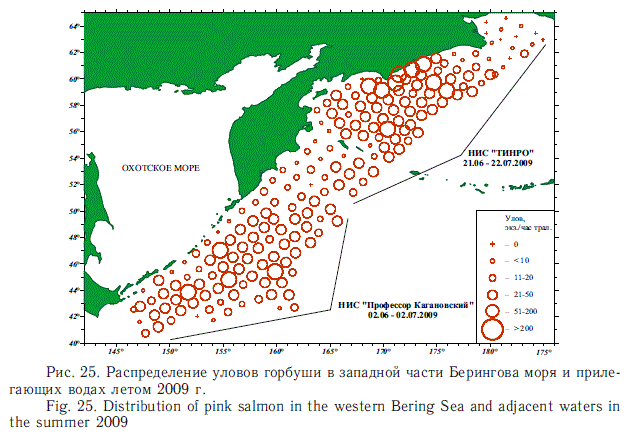
3. Тихоокеанские лососи в открытых водах ведут некосячный образ жизни. Такая стратегия рассеянного обитания при значительной подвижности этих рыб (способности к значительным горизонтальным и вертикальным маневрам) также способствуют уменьшению конкуренции за пищу уже в пределах рода Oncorhynchus, а также внутривидовой конкуренции. При перераспределениях по нагульным акваториям во все сезоны они мигрируют широким фронтом. Это хорошо видно на всех приведенных выше картах количественного распределения лососей. Дополнительно в качестве наглядного примера приводим схему подхода к азиатским берегам супермощного поколения горбуши в июне 2009 г. Почти синхронно в значительных количествах она подошла широким фронтом на всем пространстве от южных Курильских островов до мыса Наварин. И только на границе охотоморско-го и беринговоморского миграционных направлений наблюдалось некоторое понижение ее концентраций (рис. 25). В то же время в основных районах концентраций лососей, которые рассмотрены выше, зачастую наблюдается наложение областей распространения как разных видов, так и разных стад одного и того же вида. Особенно это характерно для самых массовых видов — горбуши и кеты. Эти особенности в распределении свидетельствуют, во-первых, об особой привлекательности части районов для нагула, а во-вторых — о повышенной их емкости для большого количества рыб со сходными чертами экологии.
Районы зимнего обитания азиатских тихоокеанских лососей
Крупномасштабные экспедиционные работы ТИНРО-центра в 1980-2000-е гг. уточнили и в определенной степени изменили представления о количественном распределении тихоокеанских лососей в зимний период. Подтвердились выводы прежних исследователей о том, что основные районы зимнего обитания лососей находятся в открытых водах Северной Пацифики — южнее Алеутско-Командорской гряды, включая зону Субарктического фронта (Бирман, 1985; Pacific Salmon ..., 1991). Однако большой неожиданностью для всех исследователей стали факты обнаружения всех видов лососей даже в разгар зимы в сильно охлаждающихся водах российской экономической зоны. Горбуша и сима были встречены в Татарском проливе, хотя основные зимовки лососей в Японском море находятся южнее Субарктического фронта и занимают всю глубоководную южную часть этого моря. Особенно сенсационным было обнаружение значительных скоплений сеголеток горбуши в Охотском море вплоть до января. Эти и другие факты обобщены во многих работах (см. обзор: Шунтов, Темных, 2008а).
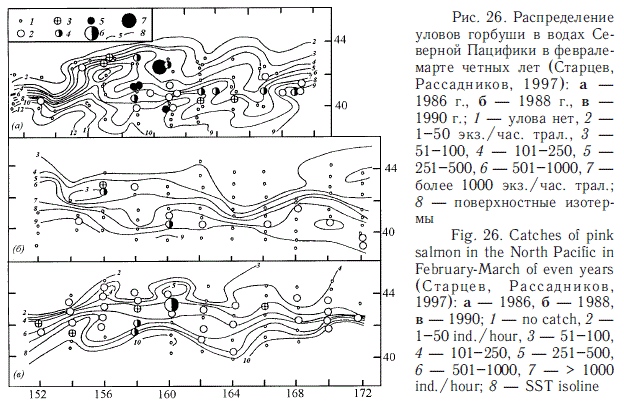
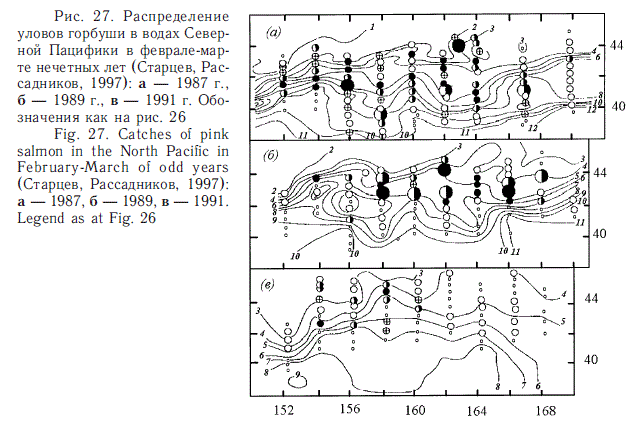
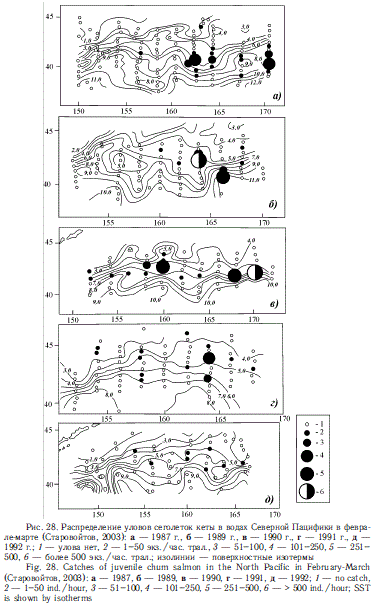
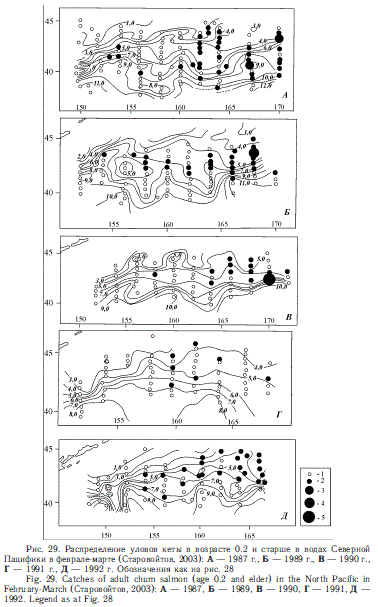
Традиционно считается, что особенно большое значение для зимнего обитания лососей имеет Субарктический фронт (Бирман, 1985). Для лососей в это время свойственно поясное распределение. Последнее было подтверждено экспедициями ТИНРО-центра в 1980-е гг. (Глебов, Рассадников, 1997; Старцев, Рассадников, 1997; Старовойтов, 2003; Шунтов, Темных, 2008а). Эту особенность распределения демонстрируют рис. 26-29, построенные по материалам тех лет.
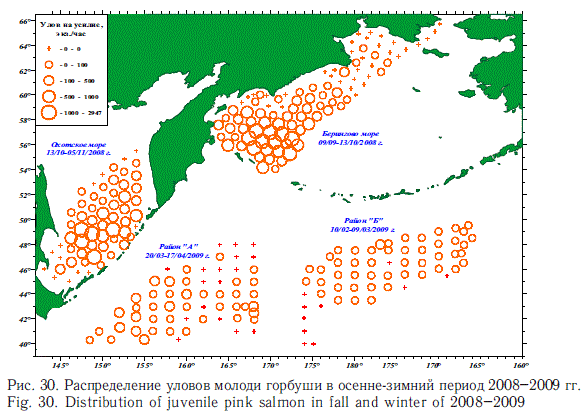
Дальнейшие наблюдения показали, что реальная картина количественного распределения лососей в зимний период более сложная. В частности оказалось, что ранее (Бирман, 1985) недооценивалось значение для зимовок лососей западной части Субарктического фронта, что связывалось с высокоградиентностью температурных полей в этой части Северной Пацифики. В реальности оказалось, что температурные контрасты в пределах их "лососевого диапазона" не играют большой роли в распределении лососей. И что весьма существенно — все виды лососей эвритермны, особенно к относительно пониженному температурному фону на уровне 1-3 оС, ранее считавшемуся непригодным для их обитания. Показательными в этом смысле оказались результаты зимней экспедиции ТИН-РО-центра в открытые воды Северной Пацифики в 2009 г. Наиболее значительные скопления горбуши охотоморских стад были оконтурены именно в западной части зоны Субарктического фронта, т.е. непосредственно перед южнокурильским районом, а максимальные концентрации отмечены при низкой температуре (2 оС), при этом они не тяготели к узкому широтному поясу (рис. 30).
В приалеутских водах, где зимуют беринговоморские стада, лососи также имели широкое распространение и располагались значительно севернее Субарктического фронта. Судя по конфигурации района концентраций (рис. 30), значительная часть их простиралась и севернее, т.е. в американскую экономическую зону.
Выше отмечалось, что области распространения азиатских и американских стад лососей в зимний период, а также при летнем нагуле частично перекрываются, а наиболее массовые из них азиатские стада кеты и горбуши проникают в восточные районы Северной Пацифики в большей степени, чем американские стада на запад.
Северная часть Тихого океана к северу от 40о имеет площадь около 11 млн км2. На всей или почти на всей этой акватории лососи присутствуют в период с конца осени до начала весны, хотя в конкретные отрезки времени большая их часть распространена более локально. В целом же, по-видимому, можно принять, что к области обитания азиатских стад горбуши в холодный период относится 60 % акватории Северной Пацифики, а кеты — 70-80 %.
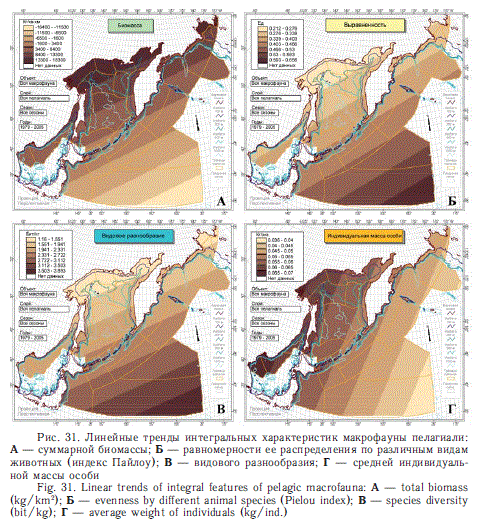
В заключение настоящего раздела рассмотрим глобальные тренды некоторых интегральных характеристик макрофауны (в основном нектона) в пелагиали дальневосточных морей и СЗТО (рис. 31). Хорошо видно, что тренды ориентированы не с севера на юг, т.е. в соответствии с глобальной широтной зональностью, а с северо-запада на юго-восток (от берегов к открытому океану). Связано это с климато-гидрологическими особенностями субарктической части северозападной Пацифики. Во-первых, большое значение имеет дислокация и взаиморасположение основных атмосферных центров погоды — Сибирского и Гавайского. Во-вторых, в отличие от более южных широт здесь преобладают меридиональные, а не широтные перемещения не только воздушных, но и водных масс. В-третьих, этим чертам циркуляции в основном соответствуют направления береговых очертаний и рельефа морского дна. Таким образом, для рассматриваемого региона в большей степени свойственна циркумконтинентальная, а не широтная зональность (Волвенко, 2008, 2009а, б). В связи с изложенным становится понятном, почему в сезонных перемещениях от лета к зиме и от зимы к лету у большинства стад азиатских тихоокеанских лососей исторически сформировались генеральные направления с северо-запада на юго-восток осенью и с юго-востока на северо-запад весной. В этом заложена и одна из первопричин значительной разобщенности в океане азиатских стад охотоморского и западноберин-говоморского бассейнов. Зимовки первых в большей степени тяготеют к западной части Субарктического фронта (СЗТО), а вторых — к водам южнее Алеутских островов (к центральной части Северной Пацифики). В общих чертах эта разобщенность сохраняется даже при заметных межгодовых различиях в дислокации различных стад. Следовательно, выводы об условиях зимовок, а также осеннего и весенне-летнего нагула лососей этих крупных совокупностей нельзя переносить с одного региона на другой.
Выводы
Морские и океанические нагульные области тихоокеанских лососей занимают обширные акватории субарктической Пацифики, а также Берингова, Охотского, Японского и Чукотского морей общей площадью около 15 млн км2. В теплые и холодные сезоны года они встречаются примерно на половине этой площади: зимой — в зоне Субарктического фронта с сопредельными с севера водами южнобореальной области, летом — в дальневосточных морях с сопредельными с юга северобореальными водами Тихого океана.
Имеющие более высокую численность азиатские стада кеты и горбуши на восток проникают для нагула дальше, чем американские стада этих видов на запад. Азиатские стада горбуши осваивают до 60 % акватории Северной Паци-фики, а кеты — до 70-80 %. Напротив, имеющие более высокую численность американские стада нерки, кижуча и чавычи проникают на запад дальше, чем азиатские стада этих видов на восток. Последнее особенно выражено в Беринговом море и приалеутских водах.
В российских водах основное время нагула посткатадромной молоди за пределами шельфа приходится на август — первую половину ноября. До середины сентября, т.е. летом, по значимости для нагула выделяются три акватории: южная глубоководная часть Охотского моря, западнокамчатские воды и Командорская котловина Берингова моря. Осенью в глубоководной части Охотского моря на площади 0,5-0,7 млн км2 формируется наиболее крупная нагульная акватория посткатадромной молоди лососей (горбуша, кета). В конце осени — начале зимы молодь выходит в прикурильские воды и, продолжая нагул, постепенно смещается в юго-восточно-восточном направлении в зону, прилегающую к западной части Субарктического фронта. Второй крупный район осеннего нагула посткатадромной молоди лососей формируется на площади до 0,5 млн км2 в глубоководных котловинах западной части Берингова моря. В конце осени молодь из этих районов смещается на юго-восток в приалеутские воды и сопредельные части центральной Северной Пацифики. Бытующие взгляды об ограниченном значении для зимнего обитания лососей зоны западной части Субарктического фронта не соответствуют действительности, особенно в настоящее время. Вопреки распространенным представлениям в зимний период лососи частично остаются в сильно охлаждающихся южных районах российской экономической зоны.
В связи с тем что приазиатским водам Северной Пацифики в большей степени свойственна циркумконтинентальная, а не широтная зональность (основные климато-гидрологические тренды и тренды, характеризующие пространственную динамику биоразнообразия, направлены не с севера на юг, а с северо-запада на юго-восток), при сезонных перемещениях лососей от лета к зиме и от зимы к лету исторически сформировались генеральные направления с северо-запада на юго-восток осенью и с юго-востока на северо-запад весной. В этом заложены первопричины разобщенности посткатадромной молоди и частично анадромных рыб охотоморских и западноберинговоморских бассейнов. Поэтому выводы об условиях обитания стад этих двух крупных совокупностей нельзя переносить с одного региона на другой.
Основные нагульные акватории крупной молоди (в возрасте одного морского года и старше) и взрослых лососей в пределах российской экономической зоны включают около 3 млн км2 глубоководных районов Охотского и Берингова морей, а также тихоокеанских вод Курильских островов и восточной Камчатки.
В общей сложности через российскую экономическую зону при нагуле в течение года в настоящее время проходит до 2,0-2,5 млн т тихоокеанских лососей с абсолютным преобладанием горбуши и кеты. У последнего вида более половины приходится на японские искусственные стада. Горбуша в российских водах на 99 % относится к местным популяциям.
От общей биомассы нектона (пелагические рыбы и кальмары) в эпипелаги-али российских вод на долю лососей приходится 4-6 %, а от биомассы нектона всей пелагиали — 2-3 %.
Основной нагул тихоокеанских лососей, где они наращивают большую часть своей ихтиомассы, протекает за пределами шельфа, где на большей части акватории субарктических вод численность других эпипелагических рыб относительно невысокая. Таким образом, тихоокеанские лососи на соответствующем эволюционном этапе освоения морской среды в значительной степени пространственно и биотопически "разошлись" с другими эпипелагическими планктоно-ядными рыбами. В верхней эпипелагиали в районах основного нагула (за пределами шельфа) доля лососей в общей биомассе нектона гораздо выше по сравнению с этим показателем для любого бассейна в целом: осенью в Охотском море — в среднем 66 %, в Беринговом море — 50, летом в СЗТО — 30, в Беринговом море — 56 %.
Тихоокеанские лососи во время морского и океанического нагульных периодов в открытых водах ведут некосячный образ жизни, рассредоточиваясь на обширных акваториях. Такая стратегия рассеянного обитания при значительной подвижности этих рыб (способность к значительным горизонтальным и вертикальным маневрам) способствует уменьшению внутривидовой, а также в пределах рода ОпсоАупЛ^ конкуренции за пищу.
В.П. Шунтов, И.В. Волвенко, О.С. Темных, А.Ф. Волков, А.В. Заволокин, С.В. Найденко, Н.Т. Долганова*
Тихоокеанский научно-исследовательский рыбохозяйственный центр, 690091, г. Владивосток, пер. Шевченко, 4
* Шунтов Вячеслав Петрович, доктор биологических наук, профессор, главный научный сотрудник, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.; Волвенко Игорь Валентинович, доктор биологических наук, ведущий научный сотрудник, e-mail: volvenko@ tinro.ru; Темных Ольга Сергеевна, доктор биологических наук, заведующая лабораторией, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.; Волков Анатолий Федорович, доктор биологических наук, ведущий научный сотрудник, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.; Заволокин Александр Владимирович, кандидат биологических наук, старший научный сотрудник, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.; Найденко Светлана Васильевна, кандидат биологических наук, старший научный сотрудник, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.; Долганова Наталья Такеновна, кандидат биологических наук, заведующая сектором, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра..